
Читайте также:
|
Типы связей: Ван-дер-Ваальса, ионная, ковалентная. Наиболее общим видом связи, которая возникает между атомами и молекулами являются силы Ван-дер-Ваальса. Разделение химически активных элементов на металлы и металлоиды позволяет ввести три основных типа связи: металлическая, ковалентная и ионная. Связь между сильно электроположительными металлами и электроотрицательными неметаллами трактуется как ионная связь. Так как она осуществляется между противоположно заряженными ионами, то ее называют — по полярности ионов — гетерополярной. К гомополярнымотносят металлическую и ковалентную связи. Металлическая связь реализуется между металлами и металлами; а ковалентная — между неметаллами и неметаллами или металлоидами. Названные типы связей являются предельными случаями химического взаимодействия. В реальной ситуации ковалентные связи в чистом виде редко реализуются и имеют в какой-то мере частично ионный характер. Соединений, близких к идеально ионным, также чрезвычайно мало.
Долю частично ионного характера (степень ионности или ионность) ковалентной связи можно оценить, если известны электроотрицательности взаимодействующих атомов А и В. Заметим, что при анализе характера связи обычно принято рассматривать не сами электроотрицательности, а разность электроотрицательностей взаимодействующих атомов.
Для оценки ионности соединения удобно воспользоваться выражением:
относительная ионность=1—ехр[—0,25 (ХА — Хв)2], (2.2)
где ХА и Хв — электроотрицательности взаимодействующих атомов А и В.
Если относительная ионность равна 1, т. е. составляет 100%, то связь между атомами чисто ионная; если же она равна 0, то связь чисто ковалентная. В промежутке между 0 и 1 имеем ковалентную связь с частично ионным характером. Чем больше разность электроотрицательностей, т. е. чем даль-
ше отстоят два элемента один от другого в ряду электроотрицательности, тем отчетливее проявляется ионный характер связи.
Одним из экспериментальных подтверждений того, что ионная связь в кристаллах должна рассматриваться лишь как предельный случай частично ионной связи, является тот факт, что эффективный заряд атома, входящего в состав того или иного соединения, определяемый как алгебраическая сумма его отрицательного электронного и положительного заряда ядра, как правило,, не равен целому числу зарядов электрона е (табл. 2.2).
Как видно из таб. 2.2, один и тот же элемент в разных соединениях имеет различные эффективные заряды. Например, в NaCl эффективный заряд атома Na равен +0,92 е, а в NaBr составляет +0,83 е. По-видимому, при взаимодействии происходит перераспределение заряда между атомами до тех пор, пока разность электроотрицательностей не станет равной нулю. Так как один и тот же атом может вступать во взаимодействие с различными атомами, каждый из которых имеет свою электроотрицательность, то и эффективные заряды рассматриваемого атома в различных соединениях различны.

Почти в чистом виде проявляются между молекулами хим.связей кислорода, азота. В общем случае связь включает в себя дисперсионное,индукционное взаимодействие.
Рассм. Связи, возникающие вследствие согласованного движения электронов соседних атомов(дисперсионные).

Рис1.
Распределение электронной плотности облака сферической симметрии. Электронный момент гелия равен нулю. Нов каждый момент времени электрон расположен в определенной точке пространства и создает мгновенные электронные диполи. При сближении их атомов в движении этих электронов возникает взаимодействие, которое носит двоякий характер. Рис.1-между мгновенное Диполями –притяжение, что приводит к появлению сил связей между атомами, б)-отталкивание. Такие силы связи, которые возникают в результате согласованного движения электронов, называются дисперсионными.
Ориентационное взаимодействие.
Если молекула полярна(постоянный дипольный момент),то между ними возникают электронно-статическое взаимодействие. Она стремится расположить молекулу в определенном порядке. Такая правильная ориентация нарушается тепловым взаимодействием. Энергия системы, которая определяется такой ориентацией молекул, сильно зависит от температуры.

При низких температурах –полная ориентация молекул- энергия взаимодействия:
 где r- расстояние между молекулами.
где r- расстояние между молекулами.
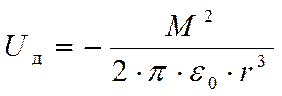 ,где М-молярная масса
,где М-молярная масса  -диэлектрическая постоянная.
-диэлектрическая постоянная.
Для высоких температур:
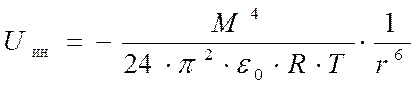
Индукционное взаимодействие.
У полярных молекул может возникнуть наведенный индуцированный) момент под действием поля постоянных диполей. Энергия взаимного притяжения,которая возникает между атомами 1 и 2 диполей:
 , где
, где  -поляризуемость
-поляризуемость
В общем случае- 3 вида связей и энергия взаимодействия будет складываться:

Индуцировано взаимодействие для всех веществ мало.
У кристаллов основное - дисперсионное.
Силы Ван-дер-Ваальса характерны для молекул крисиаллов.Это рыхлые структуры с малым координационным числом и низкой тепературой плавления.
Ионная
Атомы стоят рядом с инертным газом.Они обладают способностью постоянно отдавать и принимать электроны. У атомов щелочных металлов валентный электрон движется вне заполненного электронного уровня и может переходить с одного уровня на на другой.у галогенов (Cl) не хватает одного электрона для заполнерния электронной оболочки, они могут принять электрон. Связь между атомами такого рода- ионная.
Сначала происходит перезагрузка обоих атомов (От атома металла к атому галогена). Атом металла превращается «+» заряженный ион,галоген—в «-».
Эти ионы взаимодействуют по з-ну Кулона.


При  ионы стремятся приблизиться друг к другу,такому сближению препятствуют силы отталкивания которые проявляются на малых расстояниях и быстро растут с уменьшением расстояния(кривая 2).
ионы стремятся приблизиться друг к другу,такому сближению препятствуют силы отталкивания которые проявляются на малых расстояниях и быстро растут с уменьшением расстояния(кривая 2).
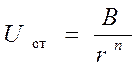 ,где B и n-константы
,где B и n-константы
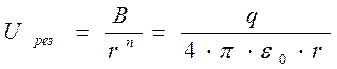
При  ,энергия проходит через тело,глубина этого тела-энергия между ионами,
,энергия проходит через тело,глубина этого тела-энергия между ионами,  - расстояние между ионами в молекуле.В равновесном состоянии силы притяжения должны быть равны силам отталкивания.
- расстояние между ионами в молекуле.В равновесном состоянии силы притяжения должны быть равны силам отталкивания.
 ,где А- константа Маделунга,
,где А- константа Маделунга,
N-число молекул,
А- учитывает энергию взаимодействия данной молекулы с соседними в кристалле.
Ионная связь осуществляется силами электростатического взаимодействия. Эти ионы образуются из избытка и недостатка электронов.
Связь малонаправленная. Характерны большие координационные числа и стремление к плотной упаковке(большинство диэлектриков),с увеличением темрпературы – электропроводность увеличивается.
У ионных кристаллов электропроводность связана с давлением ионов,что связанно с переходом массы.Ионныые кристаллы прозрачны для электро-магнитных частот вплоть до частоты поглощения(собственная частота колебаний ионов в решетке).
Ковалентная.
Осуществляется с помощью спаренных(обобществленных) электронов.Второй внешний электрон с противоположными спинами принадлежит одновременно двум атомам.Связь строго направлена.Малые координационны числа, отсутствие плотной упаковки,сильная температурая зависимость запрещенной зоны.Обобществление электронов осуществляется перераспределением электронной плотности и изменением энергии изолированных атомов.
Дата добавления: 2015-10-16; просмотров: 142 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Полиморфизм | | | КЛАССИФИКАЦИЯ ДЕФЕКТОВ |