
|
Читайте также: |
Явление автоморфотропии, т. е. существование химического соединения в двух или нескольких модификациях, различающихся между собой кристаллическими структурами, а следовательно, и физическими свойствами, — это не что иное, как открытый в 1821 г. немецким ученым Э. Митчерлихом полиморфизм.
Полиморфизм— одно из основных свойств кристаллического вещества — заключается в приспособлении структуры к меняющимся внешним условиям среды, т. е. это реакция кристаллического вещества на изменение физико-химических условий. И поскольку полиморфные превращения можно считать фазовыми превращениями, аналогичными переходу из одного агрегатного состояния в другое, то они подчиняются всем законам физической
химии.
Полиморфизм простых веществ — элементов (S, С, Р) часто называют аллотропией. Для различных полиморфных модификаций одного и того же вещества приняты буквенные обозначения а, р, f и пр. Так, для железа известны модификации: α-Fe, p-Fe, β-Fe,  -Fe, отличающиеся как структурой, так и физическими свойствами.
-Fe, отличающиеся как структурой, так и физическими свойствами.
Полиморфные превращения, которые происходят при изменении температуры, но при постоянном давлении, делятся на две большие группы: энантиотропные (обратимые) и монотропные (необратимые) (греч. энантиос — противоположный, тропос — изменение).
При энантиотропном превращении точка перехода из одной Модификации в другую лежит ниже температуры плавления вещества, т. е. существует температура (при определенном давлении), при которой обе модификации находятся как бы в равновесии. Это превращение обратимо (двустороннее): ниже температуры перехода устойчива одна модификация, выше — другая.
Например, известны две модификации серы: ромбическая и моноклинная. Точка перехода одной модификации в другую соответствует Т = 95,6°С, т. е. охлаждение приводит к ромбической структуре, нагревание — к моноклинной.
Для кварца также известны две модификации: низкотемпературная (a-кварц) и высокотемпературная (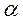 -кварц). Переход одной модификации в другую происходит легко при Т = 573°С с изменением симметрии (
-кварц). Переход одной модификации в другую происходит легко при Т = 573°С с изменением симметрии ( -кварц— L33L2, (3-кварц— L66L2).
-кварц— L33L2, (3-кварц— L66L2).
Если перестройка совершается быстро, то внешняя форма «не успевает» за изменением структуры и остается неизменной — образуется параморфоза.

Рис. 146. Полиморфные модификации TiO2: а — рутил; б — анатаз; в — брукит; г — синтетическая
Минералы с четко выраженной точкой полиморфного перехода могут служить температурными индикаторами — геологическими термометрами.
При монотрорном превращении точка перехода из одной модификации в другую лежит выше температуры плавления данного вещества. Эти переходы необратимы, точнее, обратный переход может осуществиться лишь через разрушение структуры — через жидкое или газообразное состояние. Например, одна из модификаций СаСОз — арагонит —при нагревании до температуры выше 172
одной модификации в другую происходит легко при Т = 573°С с изменением симметрии ( -кварц— L33L2, (3-кварц— L66L2).
-кварц— L33L2, (3-кварц— L66L2).
Если перестройка совершается быстро, то внешняя форма «не успевает» за изменением структуры и остается неизменной — образуется параморфоза.
Минералы с четко выраженной точкой полиморфного перехода могут служить температурными индикаторами — геологическими термометрами.
При монотрорном превращении точка перехода из одной модификации в другую лежит выше температуры плавления данного вещества. Эти переходы необратимы, точнее, обратный переход может осуществиться лишь через разрушение структуры — через жидкое или газообразное состояние. Например, одна из модификаций СаСОз — арагонит —при нагревании до температуры выше 172
400 °С при нормальном давлении переходит в кальцит. Однако охлаждение последнего к образованию арагонита не приводит. Так же, из двух известных модификаций углерода — графита и алмаза, связанных монотропным переходом, неустойчив алмаз, который при повышенных температурах переходит в 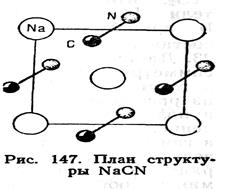 графит. Однако подобные превращения практически настолько замедленны, что при обычных Р, Г-условиях существуют обе модификации.
графит. Однако подобные превращения практически настолько замедленны, что при обычных Р, Г-условиях существуют обе модификации.
По структурному признаку выделяют несколько типов полиморфных превращений. Наблюдаются превращения, в которых не затронута первая координационная сфера. Например, при переходе от ромбической модификации серы к моноклинной, структуры которых образованы 8-членными кольцами из атомов S, изменяется лишь их взаимное расположение. К этому типу относятся и полиморфные превращения ТiO2. Во всех четырех модификациях этого соединения атомы Ti окружены по октаэдру атомами кислорода, образующими плотнейшие упаковки с заполнением половины октаэдрических пустот атомами Ti. Структуры модификаций различаются сложностью плотнейших упаковок и мотивами заполнения пустот (рис. 146): в структуре рутила — гексагональная плот-нейшая упаковка, анатаза — кубическая,
брукита — 4-слойная, в 4-й, синтетической, модификации, так же как и в рутиле, — гексагональная. Однако если в рутиле Ti-октаэдры выстроены в прямолинейные полосы, то в остальных — в зигзагообразные.
Другой тип полиморфизма предполагает изменение 1-й координационной сферы. К этому типу относятся такие переходы, как графит — алмаз (в данном случае гетеродесмическая слоистая структура графита (КЧС = 3) с ковалентными связями в слоях и ван-дер-ваальсовыми между ними переходит в гомодесмическую структуру алмаза (КЧс = 4) с только ковалентной связью); низкотемпературное a-Fe (КЧ=8) — высокотемпературное -y-Fe (КЧ=12); модификации оксида германия GeO2, одна из которых при нормальных условиях относится к структурному типу рутила (КЧ = 6), а другая — высокотемпературная — подобна кварцу (КЧ = 4).
Существуют полиморфные переходы, связанные с вращением отдельных групп атомов или молекул. Например, в производной от NaCl структуре NaCN атомы Na расположены так же, как в структуре NaCl, а центры группы (гантели) CN совпадают с позициями ионов С1 (рис. 147). Ориентация гантелей CN обусловливает ромбическую симметрию этого кристалла. При повышении температуры гантели CN начинают свободно вращаться, имитируя сферическую симметрию, что повышает симметрию всей структуры кристалла NaCN до кубической (структурный тип NaCl).
Гидроокиси, как правило, относительно низкосимметричны за счет присутствия диполей ОН-. Однако симметрия их высокотемпературных модификаций, например КОН и NaOH, повышается благодаря вращению диполей.
Изменение симметрии при полиморфных переходах может быть связано не только с вращением группы атомов, возникающим при повышении температуры, но и со степенью упорядочения атомов в определенных позициях, обусловленными различной скоростью кристаллизации. Например, структуры минералов герсдорфита NiAsS и кобальтина CoAsS построены по типу пирита FeS2: атомы Ni (Co) расположены в позициях Fe, гантели [As—S] занимают позиции гантелей S—S пирита. В природных образцах обнаружены кристаллы одинакового состава, но с разной симметрией: mЗ (как у пирита) и 23. Данные структурных расшифровок показали, что повышенная симметрия обязана беспорядочному заполнению позиций As и S в гантелях, обусловленному быстрой кристаллизацией минерала из расплава, при которой эти атомы не успевают расположиться в позициях структуры закономерно. Если охлаждение идет медленно, то происходит упорядочение расположения атомов As и S в гантелях, что понижает симметрию до точечной группы 23. Известны структуры средней степени упорядоченности. Степень упорядочения используется геологами для восстановления условий минералообразования — скорости процессов кристаллизации. А сами минералы в этом случае являются как бы геологическими спидометрами.
Нечто подобное наблюдается и в полевых шпатах, где разупорядоченное расположение атомов Si и А1 указывает на высокую скорость кристаллизации магматического расплава, тогда как упорядоченное — на длительный отжиг, т. е. медленное остывание магмы. И симметрия кристаллов в этом случае оказывается пониженной (триклинной вместо моноклинной). Таким образом, степень упорядоченности может служить одним из факторов, указывающих на условия минералообразования — скорость протекания процессов кристаллизации.
Дата добавления: 2015-10-16; просмотров: 184 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ИЗОМОРФИЗМ. | | | Типы связей |