
|
Читайте также: |
Впервые КТ для диагностики ан-
гиодисплазий применили Mitty и
Kleiger (1978). КТ-картина ангио-
дисплазий складывается из нали-
чия в подкожной жировой клетчат-
ке множества мелких (3—10 мм)
узелковых образований плотностью
10—40 ед.Н. и тонких полосок
(толщиной 2—3 мм, длиной 3—
5 мм), являющихся расширенными
сосудами в срезе. Внутри узелков
встречаются кальцинаты. При рас-
пространении ангиодисплазий на
мышцы плотность их снижается,
толщина мышечных пучков умень-
шается, несмотря на общее утол-
щение мышцы (рис. 2.101). При
внутривенном усилении плотность
ангиоматозных узлов повышается.
Иногда удается обнаружить один
из главных питающих сосудов.
Считается, что КТ не может диф-
ференцировать артериовенозную и
венозно-кавернозную формы ан-
гиодисплазий. Мы можем предло-
жить ряд признаков для этой цели.
Для артериовенозной формы более
характерны мелкие узловые обра-
зования в подкожной жировой
клетчатке, быстрое накопление в
них контрастного вещества, раннее
появление контрастного вещества
в отводящей вене по сравнению с
противоположной аналогичной ве-
ной, наличие небольшого количе-
ства и мелких (1—3 мм) флеболи-
тов. При венозно-кавернозной
форме узловые образования более
крупные, сливающиеся, с менее
четкими контурами, содержат бо-
льшое количество крупных (5—
10 мм) флеболитов, накапливают
контрастное вещество в отсрочен-
ную фазу (рис. 2.102).
Считается, что КТ в 97 % случаев
определяет локализацию, размеры
ангиодисплазий, степень вовлече-
ния мягких тканей, глубину пора-
жения и топографоанатомические
взаимоотношения в зоне пораже-

Рис. 2.100. Аневризмы подколенных
областей после внутривенного введе-
ния контрастного вещества.
1 — в аневризме правой подколенной арте-
рии контрастируется просвет и определяется
пристеночный тромб; 2 — тромбированная
аневризма левой подколенной артерии.

Рис. 2.101. Артериовенозная форма ан-
гиодисплазий промежности.
а — нативный скан: 1 — узелковые образо-
вания в жировой клетчатке; 2 — мышцы с
измененной структурой; б — скан после
внутривенного усиления: 1 — контрастиру-
ются ангиоматозные узлы в жировой клет-
чатке и мышцах.

Рис. 2.102. Венозно-кавернозная фор-
ма ангиодисплазии лица и подчелюст-
ной области.
1 — множество крупных ангиоматозных уз-
лов, содержащих большое количество круп-
ных флеболитов.
ния [Лукьянченко А.Б., 1991; Кар-
мазановский Г.Г., 1993; Шу-
бин А.А., 1996].
2.6.11. КТ-диагностика заболеваний
магистральных вен1
Верхняя полая вена образуется из
слияния левой и правой плечего-
ловных вен. На компьютерных то-
мограммах левая плечеголовная
вена расположена в переднем сре-
достении на уровне дуги аорты, но
может располагаться на уровне пе-
рехода восходящего отдела аорты в
дугу, а иногда перед плечеголовны-
ми артериями. Вена попадает в срез
в продольном направлении и, как
правило, определяется отдельными
участками. Отмечается ее неболь-
шое сужение в переднезаднем на-
правлении на уровне пересечения с
аортой. Правая плечеголовная вена
короче левой, на КТ-сканах в попе-
речном срезе имеет вид овала или
круга. Впадающие в плечеголовные
вены внутрение грудные вены, вена
вилочковой железы и нижние вены
щитовидной железы на КТ-сканах
не определяются даже при контра-
стном усилении. Верхняя полая
вена расположена в переднем сре-
достении. Диаметр ее 2—2,5 см,
длина 5—6 см. На КТ-сканах (см.
рис. 2.67) она прилежит к правозад-
ней поверхности стенки восходя-
щего отдела аорты. Кзади к вене
прилежит правая ветвь легочной
артерии, за ней — правый главный
бронх, в дистальном отделе сзади —
правая верхняя легочная вена, лате-
рально — париетальная плевра и
легкое, впереди — легкое и в диста-
льном отделе — ушко правого пред-
сердия, после чего вена вливается в
правое предсердие. Форма вены в
сечении меняется от круглой в про-
ксимальной части до овальной и
полулунной в дистальном сегменте.
Во внутриутробном периоде в
случае сохранения дистальной час-
ти левой общей яремной вены и ле-
вого кювьерова протока формиру-
ется вторая (левая) верхняя полая
вена, впадающая в коронарный си-
нус. У больного в этом случае на
КТ-сканах определяется добавоч-
ная левая верхняя полая вена, кото-
рая собирает кровь из верхней ле-
вой половины тела. На сканах (рис.
2.103) она обнаруживается сначала
в переднем средостении слева от
дуги аорты, далее спереди от левой
ветви легочной артерии и верхней
левой легочной вены, а затем пово-
рачивает к задней стенке левого
предсердия, после чего эта вена не
дифференцируется от сердца (на
месте впадения в коронарный си-
нус). Исследование желательно
проводить после внутривенного
введения контрастного вещества в
левую кубитальную вену. Начало
1 Раздел написан в соавторстве с докт.
мед. наук Е.Б.Гузеевой.
сканирования — через 7 с после на-
чала введения контрастного веще-
ства.
В норме наружные яремные вены
впадают в подключичные вены са-
мостоятельными стволами, внут-
ренние яремные вены, сливаясь с
подключичными венами, образуют
плечеголовные вены. При сохране-
нии внутриутробного варианта на-
ружные яремные вены могут впа-
дать во внутренние яремные вены
на шее, что приводит к расшире-
нию как наружных вен, так и дис-
тальных участков внутренних ярем-
ных вен. Больные в этом случае об-
ращаются с жалобами по поводу
образований на шее, которые набу-
хают при наклонах и натуживании.
Увеличение диаметра внутренних
яремных вен, однако, чаще связано
с нарушением оттока крови по ним
вследствие сдавления венозной си-
стемы в средостении. Уменьшение
же калибра одной из внутренних
яремных вен возможно при резком
сужении или тромбозе внутренней
сонной артерии с той же стороны.
Нижняя полая вена (НПВ) — са-
мый большой венозный ствол чело-
веческого тела, она собирает кровь
от нижних конечностей, органов и
стенок таза и брюшной полости.
Располагается НПВ забрюшинно;
начинается на правой переднебоко-
вой поверхности IV—V поясничных
позвонков из слияния двух общих
подвздошных вен и от места своего
начала следует вверх к отверстию
полой вены в диафрагме.
На аксиальных КТ-срезах попе-
речное сечение нижней полой
вены, имеющее форму овала или
круга, постепенно увеличивается от
начала к диафрагме. Контуры вены
всегда ровные, четкие, стенка ее не
определяется. В краниальном отде-
ле вена отклоняется вправо и кпе-
реди от своего начального хода, со-
относясь с положением вырезки
заднего края печени и собственного
отверстия в диафрагме. Медиальная
стенка вены на большом протяже-

Рис. 2.103. Добавочная левая верхняя
полая вена. Томограмма.
1 — добавочная левая верхняя полая вена;
2 — правая верхняя полая вена; 3 — восхо-
дящий отдел аорты; 4 — нисходящий отдел
аорты.
нии прилежит к аорте и отграниче-
на от нее тонкой жировой прослой-
кой. Задняя стенка в каудальных
отделах соприкасается с фасциями
большой поясничной мышцы. Кра-
ниальнее НПВ граничит с правой
ножкой диафрагмы. Позади вены
проходят.правые поясничные арте-
рии, которые не всегда видны на
аксиальных срезах, и правая почеч-
ная артерия. На этом уровне вена
представляется расширенной, от-
клоняется немного вправо и прохо-
дит впереди медиального края пра-
вого надпочечника. Почечные вены
впадают в нижнюю полую вену
почти под прямым углом на уровне
первого поясничного позвонка. Ле-
вая вена впадает в НПВ несколько
выше правой. С этого уровня ниж-
няя полая вена лежит в вырезке
заднего края печени и играет роль
анатомического ориентира при сег-
ментарном делении печени. На пе-
редней поверхности вены в каудо-
краниальном направлении распола-
гаются корень брыжейки тонкой
кишки и правая яичковая артерия,
которые в норме, как правило, не
определяются, затем нижнегори-
зонтальная часть двенадцатиперст-

Рис. 2.104. Томограмма после внутри-
венного контрастирования.
1 — тромб в нижней полой вене; 2 — аорта.
ной кишки, над которой находится
головка поджелудочной железы и
частично нисходящая часть двенад-
цатиперстной кишки. Краниальнее
проходит корень брыжейки попе-
речной ободочной кишки, в норме
также не визуализирующийся. Са-
мый краниальный конец вены рас-
ширен и с трех сторон окружен па-
ренхимой печени — так называе-
мый печеночный синус. Печеноч-
ные вены впадают в НПВ по выхо-
де из паренхимы, по заднему краю
печени. Краниальнее вена проходит
через отверстие полой вены диа-
фрагмы и, попадая в полость пери-
карда, сразу же впадает в правое
предсердие.
В НПВ впадают пристеночные
вены (поясничные, правая надпо-
чечниковая, правая яичковая или
яичниковая и нижняя диафрагма-
льная), которые обычно не выявля-
ют при КТ.
Исследование вен таза и нижней
полой вены желательно выполнять
на спиральном компьютерном то-
мографе. Задержка при сканирова-
нии должна составлять для краниа-
льного участка нижней полой вены
40 с, для вен таза и каудального
участка нижней полой вены — 60 с.
Соответственно току крови КТ-ис-
следование НПВ проводят в кау-
докраниальном направлении. Одна-
ко в структуре исследования брюш-
ной полости НПВ, как правило, ча-
стично или на всем протяжении по-
падает в зону сканирования, и тог-
да исследование обычно проводят в
краниокаудальном направлении.
Наиболее часто встречающейся
патологией НПВ и ее ветвей явля-
ется их тромбоз. На нативных
КТ-сканах при тромбозе наружной
или общей подвздошной вены
определяются расширенная вена на
стороне поражения и низкая плот-
ность ее содержимого (25—30 ед.Н.)
по сравнению с таковыми на про-
тивоположной стороне. При введе-
нии контрастного вещества в куби-
тальную вену подвздошные вены на
стороне поражения не контрастиру-
ются. Примерно в 1/3случаев тром-
боз общей подвздошной вены рас-
пространяется на нижнюю полую
вену. Непроходимость или окклю-
зия НПВ может быть частичной,
ограниченной, полной, распростра-
ненной с появлением синдрома
нижней полой вены. Тромбоз инф-
раренального отдела НПВ встреча-
ется сравнительно часто. Более ред-
ко встречается изолированный
тромбоз почечного и печеночного
отделов НПВ. Реже окклюзия НПВ
развивается вследствие сдавления
(прорастания) ее опухолью забрю-
шинного пространства или при
идиопатическом забрюшинном
фиброзе (болезнь Ормонда). Казу-
истической редкостью являются
опухоли, исходящие из венозной
стенки (лейомиома, лейомиосарко-
ма), которые могут сочетаться с
тромбозом вены. При гипернефро-
идном раке почки, особенно пра-
вой, возможно распространение так
называемого опухолевого тромба из
почечной вены в НПВ (рис. 2.104).
Повреждения НПВ обычно соче-
таются с повреждением органов
брюшной полости, что сопровожда-
ется развитием забрюшинной или
паравазальной гематом.
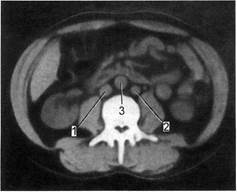
Рис. 2.105. Удвоение проксимальной
части нижней полой вены.
1 — правая нижняя полая вена; 2 — левая
нижняя полая вена; 3 — аорта.
Пороки развития. Нижняя полая
вена формируется из двух участ-
ков — короткого краниального и
более длинного каудального. Гра-
ницей между ними являются почеч-
ные вены. Краниальный участок за-
кладывается как непарный сосуд,
идущий к сердцу справа от аорты.
На каудальном конце этот сосуд че-
рез анастомозы соединяется с дву-
мя кардинальными венами, из ко-
торых кровь поступает в него. В по-
следующем из каудальной части
правой кардинальной вены образу-
ется каудальный участок нижней
полой вены, а каудальная часть ле-
вой кардинальной вены облитери-
руется. В случае облитерации кау-
дальной части правой кардиналь-
ной вены начальная часть нижней
полой вены не формируется. Кро-
воток из нижней половины тела на-
правляется по расширенным непар-
ной и полунепарной венам в верх-
нюю полую вену, а далее в сердце.
Кровь от почек и печени оттекает в
сердце по краниальному участку
нижней полой вены. В случае от-
сутствия облитерации не только
правой, но и левой кардинальной
вены происходит удвоение началь-
ной части нижней полой вены (рис.
2.105). При этом для точной диа-
гностики необходимо выявить не
только две вены справа и слева от
инфраренального отдела аорты, но
и место их слияния. Нижняя полая
вена в случае облитерации только
правой кардинальной вены может
иметь и частичное левостороннее
положение. В этом случае на уров-
не впадения левой почечной вены
она перегибается через аорту и впа-
дает в краниальный участок ниж-
ней полой вены. Редкой аномалией
является отсутствие почечно-пече-
ночного сегмента нижней полой
вены: его заменяет непарная вена, а
печеночные вены единым стволом
впадают в правое предсердие.
Таким образом, компьютерная
томография, особенно спиральная
КТ с болюсным введением контра-
стного вещества автоматическим
инъектором, является современным
высокоинформативным методом
диагностики заболеваний сосуди-
стой системы.
Литература
Беленков Ю.Н., Беличенко О.И., Сини-
цын В.Е. Магнитно-резонансная томогра-
фия в диагностике аневризм и коаркта-
ций аорты//Вестн. радиол. — 1991. —
№ 3. - С. 56-60.
Илюхин В.В., Хаджибеков М.Х. Рентгено-
эндоваскулярная дилатация коарктации
аорты//ВРИР. - 1990. - № 5. - С. 164—
169.
Кармазановский Г.Г., Федоров В.Д. Компь-
ютерная томография поджелудочной же-
лезы и органов забрюшинного простран-
ства // КТ диагностика заболеваний
брюшного отдела аорты. — М.: Паганель,
2000. - С. 164-196.
Кармазановский Г.Г., Дан В.Н., Скуба Н.Д.
КТ характеристика ангиодисплазий с ан-
гиоматозом мягких тканей//ВРИР. —
1993. - № 2. - С. 37-43.
Королев Б.А., Охотин И.К, Соловьев СИ.
и др. Хирургическое лечение коарктации
аорты у взрослых больных//Вестн. хир. —
1976. - № 2. - С. 3-6.
Никитаев И. С, Кармазановский Г.Г., Чер-
няк Б.Б. Коарктация аорты — возможно-
сти спиральной КТ // Мед. визуализа-
ция. - 2001. - № 1. - С. 54-61.
Покровский А.В. Коарктация аорты//Кли-
ническая ангиология. — М.: Медицина,
1979. - С. 63-82.
Рабкин И.Х., Овчинников В.И., Юдин А.А.
Диагностика аневризм аорты с помощью
КТ // Хирургия. - 1983. - № 10. -
С. 134-137.
Синицин В. Е., Дадвани С.А., Артюхи-
на Е.Г. и др. Компьютерная томографиче-
ская ангиография в диагностике атероск-
леротических поражений аорты и артерий
нижних конечностей//Ангиол. и сосуд.
хир. - 2000. - Т.6, № 2. - С. 37-44.
Черняк Б.Б., Коростелев А.Н., Кармазанов-
ский Г.Г. и др. Спиральная компьютерная
томография с контрастным усилением в
диагностике и предоперационном плани-
ровании коррекции коарктации аорты и
ее осложнений//Межд. мед. журн. —
2000. - № 6. - С. 502-508.
Adachi H., /по Т., Ide H. et al. Preoperative
diagnosis of the thoracic aortic aneurysm by
three-dimansional CT angiography//!. Jap.
Associat. Thorac. surg.— 1993.— Vol. 41.—
P. 1478-1486.
Allen H.D., Marx G.T., Ovit T.W. et al. Bal-
loon dilatation angioplasty for coarctation of
the aorta//Am. J. Cardiol. - 1986. - Vol.
57. - P. 828-832.
Balm R., Eikelboom B.C., van Leeuwen M.S.
et al. Spiral CT-angiography of the aorta//
Europ. J. Vase. surg. — 1994. — Vol. 8. —
P. 544-551.
Becker C, Soppa C, Fink U. et al. Spiral CT
angiography and 30 reconstruction patients
with aortic coarctation//Europ. Radiol. —
1997. - Vol. 7. - P. 1473-1478.
Belair N., Soulez G., Oliva V. et al. Aortic
graft infection: the value of percutaneous
dgainage//AJR. - 1998. - Vol. 171. -
P. 119-124.
Bradshaw K.A., Pagano D., Bonser R.S. et al.
Multiplanar reformatting and three-dimensi-
onal reconstraction: for pre-operative asses-
ment of the thoracic aorta by computed to-
mography//Clin. Radiol. - 1998. - Vol.
53. - P. 198-202.
Cholankeril J.V., Ketyer S., Cholankeril M.V.
CT detection of coarctation of the aorta//J.
Comput. Tomogr. - 1981. — Vol. 5, N 4. —
P. 355-358.
Dapunt O.E., de Asia R.A., Griepp E.B. et al.
Computer-generated 3D representations of
the aorta: a new tool in the managememt of
aortic aneurysm patients//J. Thorac. Cardio-
vasc. Surg. - 1994. - Vol. 42. - P. 25-28.
Edwards F.H., Wind G, Thompson L. et al.
Threedimensional image recostruction for
planning of a complex cardiovascular proce-
dure//Ann. Thorac. surg. — 1990. — Vol.
49. - P. 486-488.
Erbel R., Bednarezyk J., Pop T. et al. Detec-
tion of dissection of the aortic intima and
media after angioplasty coarctation of the
aorta. An angiographic, computertomograp-
hic, and echocardiographic comparative stu-
dy//Circulation. - 1990. - Vol. 81. - P.
805-814.
Farmer D.W., Lipton M.J., Webb W.R. et al.
Computed tomography in congenital heart
disease // J. Comput. Assist. Tomogr. —
1984. - Vol. 8, N 4. - P. 677-687.
Fritschen U., Malzfeld E., Clasen A., Kort-
mann H. Inflammatory abdominal aortic
aneurysm: A postoperative course of retrope-
ritoneal fibrosis//J. Vase. surg. — 1999. —
Vol. 30, N 6. - P. 1090-1098.
Garant M.L., Menke P.G., Fabian T. et al.
Hellical CT of the chest to detect blunt trau-
matic aortic rupture//Radiology. — 1995. —
Vol. 197. - P. 125-133.
Godwin J.D., Her/kens R.J., Brundage B.H. et
al. Evaluation of coarctation of the aorta by
computed tomography//J. Comput. To-
mogr. - 1981. - Vol. 5, N 2. - P. 153-
156.
Graeter Т., Schaefer C, Prokop M. et al.
Three demensional vascular imaging — an
additional diagnostic tool//Thorac. Cardio-
vasc. surg. - 1993. - Vol. 41, N 3. —
P. 250-253.
Johnson K.K., Russ P.D., Bair J.H., Frie-
feld G D. Diagnosis of synthetic vascular graft
infection: comparision with CT and gallium
scans//AJR. - 1990. - Vol. 154. -
P. 405-409.
Lupetin A.R., Dash N., Beckman I. Coarctati-
on of the aorta associate with intercostal ar-
tery aneurysms — computed tomography di-
agnosis//!. Comput. Tomogr. — 1985. —
Vol. 5, N 2. - P. 145-152.
Low R.N., Wall S.D., Jeffrey R.B. et al. Aor-
toenteric fistula and perigraf infection: evalu-
ation witt CT//Radiology. — 1990. - Vol.
175. - P. 157-162.
Marchal G, Bogaert J. Non-invasive imaging
of the graet vessels of the chest//Eur. Radiol.
- 1998. - Vol. 8, N 7. - P. 1099-1105.
Orton D.F., Le Veen R.F., Saigh J.A. et al.
Aortic prosthetic graft infection: radiologic
manifestation and managemant//Radiograp-
hics.- 2000.- Vol. 20, N 4.- P. 977- 993.
Oudkerk M., Overbosch E., Dee P. CT recog-
nition of acute aortic dissection//Am. J.
Rentgenol. - 1983. - Vol. 141. - P. 671 —
676.
Rankin S.C. CT angiography//Eur. Radiol.—
1999. - Vol. 9, N 2. - P. 297-310.
Seror 0., Fain 0., Dordea M. et al. Aortitis
with antiphospholipid antibodies: CT and
MR findings//Eur. Radiol. - 1998. - Vol.
8, N8. - P. 1373-1378.
Sultan S., Duffy S., Madhavan P. et al. Fifte-
en-year experience of transperitoneal mana-
gement of inflammatory abdominal aortic
aneurysms//Eur. J. Vase. Endovasc. surg. —
1999. - Vol. 18, N 6. - P. 510-514.
Qanadli S.D., Mesurolle В., Hajjam M. et al.
Helical computed tomography of the aorta
and its branches//.!. Radiol. — 1999. — Vol.
80, N 9. - P. 998-1010.
Vaid Y, Shin M.S., Soto B. Role of compu-
ted tomography in nonobstructive coarctati-
on//.!. Comput. Tomogr. — 1987. — Vol. 11,
N 1. - P. 95-103.
Yamada N.A. J. Cardiogr. — 1984. - Vol.
14, N 3. - P. 577-585.
2.7. Томографические методы исследования
сосудистой системы
Магнитно-резонансная томография
(MPT) и рентгеновская компьютер-
ная томография (КТ) в настоящее
время все шире применяются для
исследований сосудов.
Стандартные системы КТ
(3—4-го поколений) применялись в
основном для диагностики анев-
ризм аорты, тромбоэмболии легоч-
ной артерии. Настоящий расцвет
ангиографических исследований с
помощью МРТ и КТ произошел
после создания методик МР-анги-
ографии (МРА) и КТ-ангиографии
(КТА). Широкое использование то-
мографических методов исследова-
ний сосудов привело к тому, что
традиционная рентгеноконтрастная
ангиография все реже используется
с диагностическими целями и все
чаще — для интервенционных вме-
шательств.
Дата добавления: 2015-10-21; просмотров: 276 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| КТ-диагностика заболеваний артерий конечностей | | | Магнитно-резонансная ангиография |