
|
Читайте также: |
Рассмотрим линейную цепочку из  атомов водорода с одним атомом в элементарной ячейке. При этом будем считать, что он обладает базисной
атомов водорода с одним атомом в элементарной ячейке. При этом будем считать, что он обладает базисной  орбиталью и волновую функцию будем искать в виде:
орбиталью и волновую функцию будем искать в виде:  , Где
, Где 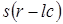 -
- 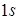 орбиталь атома водорода, расположенного в точке
орбиталь атома водорода, расположенного в точке  .
.
Базис функций 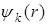 с
с  различными значениями
различными значениями  эквивалентен чисто атомному базису из
эквивалентен чисто атомному базису из  функций
функций 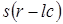 , локализованных на
, локализованных на  узлах решетки.
узлах решетки.
Преимуществом такого подхода является также то, что волновая функция 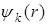 удовлетворяет теореме Блоха. Это следует из
удовлетворяет теореме Блоха. Это следует из

Т.К. оператор Гамильтона не смешивает блоховские функции с различными значениями волнового вектора, орбитали 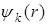 являются собственными функциями
являются собственными функциями 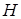 и
и
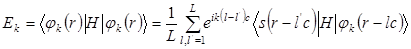 Т.к. атомные функции быстро спадают с расстоянием, поэтому можно ограничиться приближением ближайших соседей:
Т.к. атомные функции быстро спадают с расстоянием, поэтому можно ограничиться приближением ближайших соседей:

Зависимость энергии полимера от волнового вектора называют законом диперсии электронов или дисперсионной кривой.
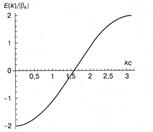 Рис.1Зонная структура цепочки из атомов водорода.
Рис.1Зонная структура цепочки из атомов водорода.
Энергия приведена в единицах  , величина
, величина 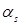 выбрана за начало отсчета энергии. Так как интеграл перескока Ps < 0, минимум электронной энергии Ek расположен при k = 0, т. е. в центре зоны Бриллюэна, а максимум на краю этой зоны при
выбрана за начало отсчета энергии. Так как интеграл перескока Ps < 0, минимум электронной энергии Ek расположен при k = 0, т. е. в центре зоны Бриллюэна, а максимум на краю этой зоны при  .
.
Число разрешенных состояний в замкнутой цепочке из атомов водорода равно числу электронов в цепочке L. Так как на каждом электронном уровне, в соответствии с принципом Паули, могут размещаться два электрона, единственная зона водородной цепочки должна быть заполнена электронами наполовину. Энергетическая щель между дважды занятыми и вакантными уровнями отсутствует, поэтому такая цепочка должна обладать металлическим типом проводимости и электронного спектра. Уровень Ферми, разделяющий занятые и вакантные состояния, расположен при Ek = as в точках  т. е. в точности посередине между центром и границей зоны Бриллюэна. Дисперсионная кривая симметрична относительно замены k на — k, поэтомуможно ограничиться рассмотрением половины зоны Бриллюэна
т. е. в точности посередине между центром и границей зоны Бриллюэна. Дисперсионная кривая симметрична относительно замены k на — k, поэтомуможно ограничиться рассмотрением половины зоны Бриллюэна 
3.12  - орбитали в соединениях углерода
- орбитали в соединениях углерода
В основном состоянии свободного атома углерода 2s22p2 два электрона не спарены. Четыре внешних (валентных) электрона атома углерода не одинаковы — они соответствуют 2s- и 2р-орбиталям (рис. 1);
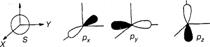 Рис.1.При образовании химической связи один 2s- электрон переходит на 2р-орбиталь (для этого требуется около 96 ккал/моль) так, что состояние атома может быть выражено как 2s12p3. В результате получается атом с тремя
Рис.1.При образовании химической связи один 2s- электрон переходит на 2р-орбиталь (для этого требуется около 96 ккал/моль) так, что состояние атома может быть выражено как 2s12p3. В результате получается атом с тремя 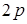 и одним 2s -электроном: 2s2px2p 2pz.
и одним 2s -электроном: 2s2px2p 2pz.
Химическая связь между атомами углерода часто описывается гибридными орбиталями. Возможны три вида гибридизации: sp-, sp2- и sр3-гибридизация.При гибридизации типа sp смешиваются две атомные орбитали s и, например, рх. При этом орбитали, 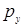 и
и  не меняются, а орбитали
не меняются, а орбитали  и s дают гибридную форму.
и s дают гибридную форму.
Так как гибридная волновая функция может иметь вид 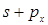 или
или  получаются две противоположно направленные орбитали (рис. 2 а).
получаются две противоположно направленные орбитали (рис. 2 а).
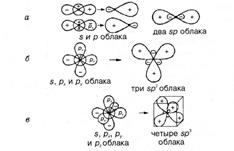
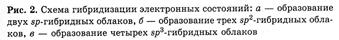
Такая гибридизация орбиталей способствует образованию тройных связей 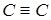 C и формированию линейных цепочек из атомов углерода. Если происходит гибридизация одной s- и двух р-функций, например
C и формированию линейных цепочек из атомов углерода. Если происходит гибридизация одной s- и двух р-функций, например 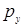 и
и  (
(  остается неизменной), получаются три атомные гибридные орбитали типа sp2.
остается неизменной), получаются три атомные гибридные орбитали типа sp2.
В основном состоянии электронная конфигурация атома 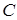 имеет вид
имеет вид 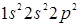 и содержит на
и содержит на 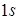 - оболочке 2 электрона, сильно связанных с ядром. Эти электроны экранируют положительный потенциал находящихся в ядре протонов и 4 валентных электрона, способных вступать в различные химические соединения. При этом основная роль остовных электронов заключается лишь в экранировании положительного потенциала ядра, и включать в базис только валентные орбитали.
- оболочке 2 электрона, сильно связанных с ядром. Эти электроны экранируют положительный потенциал находящихся в ядре протонов и 4 валентных электрона, способных вступать в различные химические соединения. При этом основная роль остовных электронов заключается лишь в экранировании положительного потенциала ядра, и включать в базис только валентные орбитали.
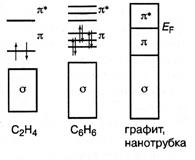 Рис.3 Разделение орбиталей на остовные и валентные и малоподвижные электроны
Рис.3 Разделение орбиталей на остовные и валентные и малоподвижные электроны  -типа и высокоподвижные электроны
-типа и высокоподвижные электроны  -типа возможно не для всех соединений углерода, а таких как этилен, бензол, графит, но не алмаз и не метан. Взаимное расположение
-типа возможно не для всех соединений углерода, а таких как этилен, бензол, графит, но не алмаз и не метан. Взаимное расположение  - и
- и 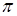 - уровней в соединениях углерода
- уровней в соединениях углерода  - и
- и 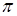 - связями показано на рис.3
- связями показано на рис.3  - уровни и связывающие
- уровни и связывающие 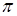 -состояния заполнены электронами, а разрыхляющие
-состояния заполнены электронами, а разрыхляющие 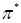 - уровни вакантны.
- уровни вакантны.
Низкоэнергетичные возбуждения таких систем обусловлены переходами электронов между занятыми и вакантными состояниями  -типа.
-типа.
Возможность исключения из рассмотрения для ряда соединений углерода глубоколежащих 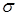 - уровней позволяет сократить атомный базис и записать секулярные уравнения ограничившись приближением уровней
- уровней позволяет сократить атомный базис и записать секулярные уравнения ограничившись приближением уровней  -типа для одномерных цепочек, построенных из атомов углерода.
-типа для одномерных цепочек, построенных из атомов углерода.
3.13  -уровни карбина с двойными связями. Дисперсионная кривая.
-уровни карбина с двойными связями. Дисперсионная кривая.
Рассмотрим полимер углерода  , - карбин. Для определенности предп, ось трансляций совпадает с осью
, - карбин. Для определенности предп, ось трансляций совпадает с осью  и
и 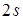 и
и  образуют две
образуют две 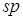 -гибридные
-гибридные 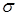 -орбитали. Выберем в качестве базиса
-орбитали. Выберем в качестве базиса  - и
- и 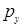 -орбитали атомов углерода и построим два набора блоховских функций:
-орбитали атомов углерода и построим два набора блоховских функций:
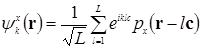 ,
, 
Гамильтониан не смешивает блоховские функции в силу того, что 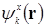 и
и 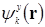 по разному преобразуются,
по разному преобразуются,  . когда функция
. когда функция 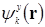 и гамильтониан не меняются,
и гамильтониан не меняются, 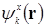 умножается на
умножается на  интеграл
интеграл  не должен измениться, а другой – умножаться на
не должен измениться, а другой – умножаться на  , это возможно лишь при его обращении в нуль. Законы дисперсии для
, это возможно лишь при его обращении в нуль. Законы дисперсии для 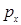 - и
- и 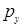 - электронов описываются тем же уравнением, что и
- электронов описываются тем же уравнением, что и  состояния водородной цепочки:
состояния водородной цепочки: 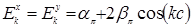 .
.
3.14  -уровни карбина с альтернированными связями. Дисперсионная кривая.
-уровни карбина с альтернированными связями. Дисперсионная кривая.
Продолжим рассмотрение уровней  - типа в линейной цепочке с альтернированием, которой соответствует структура из чередующихся тройных и одинарных связей
- типа в линейной цепочке с альтернированием, которой соответствует структура из чередующихся тройных и одинарных связей 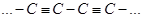 Элементарная ячейка такого атома содержит два атома, и соответственно четыре
Элементарная ячейка такого атома содержит два атома, и соответственно четыре  - электрона, две
- электрона, две 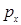 - и
- и 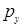 - орбитали. Волновые функции
- орбитали. Волновые функции 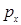 - и
- и 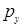 -типа по прежнему взаимодействовать не будут. Что должно привести к двукратному вырождению. Базисные блоховские функции при этом будут иметь вид:
-типа по прежнему взаимодействовать не будут. Что должно привести к двукратному вырождению. Базисные блоховские функции при этом будут иметь вид:

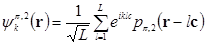 ,
,
где 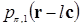 и
и 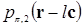 соответственно
соответственно 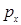 - и
- и 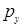 -орбитали первого и второго атомов углерода
-орбитали первого и второго атомов углерода  в ячейке
в ячейке 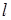 . Сокращенный базис позволяет представит секулярное уравнение в виде:
. Сокращенный базис позволяет представит секулярное уравнение в виде:
 , В приближении ближайших соседей
, В приближении ближайших соседей
 ,
,
где 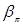
 - интегралы перескока, отвечающие более короткой
- интегралы перескока, отвечающие более короткой 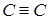 и более длинной
и более длинной  связи между атомами углерода.
связи между атомами углерода.
Дисперсионные соотношения углеродной цепочки карбина с альтернированием связей будут иметь вид:
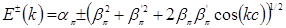 .
.
Зонная структура карбина с для случая альтернированием длин связей для случая 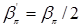 приведена на рис.4.
приведена на рис.4.
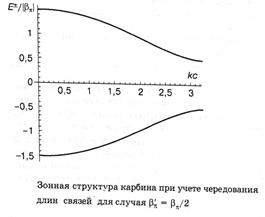 рис.4 Дисперсионные кривые
рис.4 Дисперсионные кривые  и
и 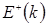 расположены соответственно ниже и выше атомного
расположены соответственно ниже и выше атомного 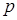 -уровня. Они отвечают полностью заполненной электронами валентной зоне и полностью незаполненной зоне проводимости. Ширина запрещенной зоны равна
-уровня. Они отвечают полностью заполненной электронами валентной зоне и полностью незаполненной зоне проводимости. Ширина запрещенной зоны равна 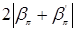 при
при 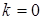 и
и  при
при  .
.
Т.о. карбин при равных длинах связей, также как и одномерная цепочка атомов водорода проявляет металлические свойства, а карбин с альнированными связями должен быть полупроводником с прямой минимальной щелью на краю зоны Бриллюэна.
Дата добавления: 2015-09-02; просмотров: 224 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Трансляционная симметрия полимеров | | | Графен. Понятие элементарной ячейки. Векторы трансляций. |