
Читайте также:
|
Задача. В исходном состоянии азот (N2) массой M 0 =3 кг имеет температуру T 1=20ºC и давление P 0=1,32 бар. При постоянном давлении (изобарный процесс) газу сообщается D Q =14,331 ккал тепла. Считая газ идеальным, найти увеличение объема газа D V, совершенную им работу, конечную температуру T 2, приращение внутренней энергии и энтальпии (D U и D H), удельную массовую и молярную теплоемкости газа при постоянном объеме (
 ). Считать, что сp (N2)=1,047 кДж/(кг·K).
). Считать, что сp (N2)=1,047 кДж/(кг·K).
Решение
а). Переводим все заданные величины в систему единиц измерения СИ:
T 1=20ºC =293,15 K,
P 0=1,32 бар = 1,32·105 Па,
D Q =14,331 ккал = 14,331·4,1868 кДж. = 60·103 Дж,
сp (N2)=1,047 кДж/(кг·K)=1047 Дж/(кг·K).
Пользуясь таблицей Менделеева, находим молярную массу атомарного азота μ(N) = 14 кг/кмоль. Определяем молярную массу молекулярного (2-атомного) азота μ = μ(N2) = 2·μ(N) = = 28 кг/кмоль.
б). Поскольку процесс идет при постоянном давлении, то dP =0. Из первого закона термодинамики в форме (4.3) следует
M D h = D H = cpM D T = D Q (Дж) >0,
D T = T 2 –T 1 = D Q/ (Mcp) = 60·103/(3·1,047·103) = 19,102 K,
T 2 = T 1+D T = 293,15+19,102 = 312,252 K.
Таким образом, определены конечная температура T 2 и приращение энтальпии D H =D Q =60 кДж > 0.
в). Поскольку газ идеальный, в исходном и конечном равновесном состояниях имеем (R 0=8314 Дж/(кмоль·К))
P 0 V 1 = M 0 · R 0/μ· T 1, (4.4)
P 0 V 2 = M 0 · R 0/μ· T 2. (4.5)
Из (4.4) можно определить V 1:
V 1 = M 0 · R 0/μ· T 1/ P 0=  .
.
Разделив (4.4) на (4.5) (отдельно левые и правые части), получим
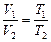
и
 .
.
Соответственно, D V = V 2 – V 1=0,1289 м3>0.
Так как в задаче требуется определить только D V, а не V 2и V 1, можно было бы вычесть из (4.5) (4.4) (отдельно левые и правые части):
P 0(V 2– V 1) = P 0 D V = (M 0 · R 0/μ)(T 2 – T 1), D V = (M 0 · R 0/μ)·D T / P 0 = 0,1289 м3.
г). Единственная работа, которую может совершать газ в отсутствие каких-либо силовых полей, – это работа против сил внешнего давления (работа расширения dA=PdV). Таким образом,
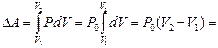
= 1,32·105·0,1289 Дж = 17,015 кДж.
Из первого закона термодинамики в форме (4.1), (4.3) следует
D U = cvM D T = D Q – D A = (60–17,015) кДж = 42,985 кДж
и
сv = D U /(M D T) = 0,750 кДж/(кг·K),
 = μ сv = 21,002 кДж/(кмоль·K).
= μ сv = 21,002 кДж/(кмоль·K).
Замечание. Теоретические, следующие из молекулярно-кинетической теории, значения
 кДж/(кмоль·K),
кДж/(кмоль·K),
 кДж/(кмоль·K).
кДж/(кмоль·K).
Задачи
4.1. Определить часовой расход топлива, который необходим для работы паровой турбины мощностью 25 МВт, если теплота сгорания топлива Q =33,85 МДж/кг, и известно, что на превращение тепловой энергии в механическую используется только 35% тепла сожженного топлива.
4.2. На тепловой электростанции за 24 ч работы сожжены 85 т каменного угля, имеющего теплоту сгорания 28900 кДж/кг. Определить среднюю мощность станции, если в электрическую энергию превращено 21% тепла, полученного при сгорании угля.
4.3. Мощность турбогенератора 12000 кВт, к.п.д. генератора равен 0,98. Какое количество воздуха необходимо пропустить через генератор для его охлаждения, если подогрев воздуха не должен превышать 40ºС, а начальная температура равна 20ºC?
4.4. Количество энергии, выделяющейся при расщеплении 1 кг ядерного горючего на АЭС, может быть условно названо «теплотой сгорания». Для урана эта величина равна 22,9 млн.кВт·ч/кг. Во сколько раз уран как горючее эффективнее каменного угля с теплотой сгорания 27500 кДж/кг?
4.5. Одним из важнейших компонентов атомной электростанции является реактор. Тепловой мощностью реактора называется полное количество тепла, которое выделяется в нем в течение часа. Обычно эту мощность выражают в киловаттах. Определить годовой расход ядерного горючего для реактора с тепловой мощностью 500000 кВт, если теплота сгорания применяемого для расщепления урана равна 22,9·106 кВт·ч/кг, а число часов работы реактора составляет 7300.
4.6. Электрическая мощность первой АЭС равна 5000 кВт, а тепловая мощность реактора станции равна 30 МВт. Определить суточный расход урана, если выработка электроэнергии за сутки составила 120000 кВт·ч. Теплоту сгорания урана принять равной
22,9·106 кВт·ч/кг. Определить также, какое количество угля, имеющего теплоту сгорания 25800 кДж/кг, потребовалось бы для выработки того же количества электроэнергии на тепловой электростанции, если бы к.п.д. ее равнялся к.п.д. АЭС.
4.7. При испытании двигателей внутреннего сгорания часто используются гидротормоза. Работа двигателя при торможении превращается в теплоту трения, и для уменьшения нагрева применяется водяное охлаждение. Определить часовой расход воды на охлаждение тормоза, если мощность двигателя равна 45 л.с., начальная температура воды 15ºC, конечная – 60ºC. Принять, что вся теплота трения передается охлаждающей воде.
4.8. При испытании нефтяного двигателя было найдено, что удельный расход топлива равен 170 г/л.с.·ч. Определить эффективный к.п.д. этого двигателя, если теплота сгорания топлива 41000 кДж/кг.
4.9. Паросиловая установка мощностью 4200 кВт имеет к.п.д. η=0,2. Определить часовой расход топлива, если его теплота сгорания 25000 кДж/кг.
4.10. Сколько килограммов свинца можно нагреть от температуры 15ºC до температуры его плавления t пл=327ºC посредством удара молота массой 200 кг при падении его с высоты 2 м? Предполагается, что вся энергия падения молота превращается в теплоту, целиком поглощаемую свинцом. Теплоемкость свинца cp =0,1256 кДж/(кг·К).
4.11. С высоты 92 м на твердую поверхность падает свинцовый шар. При этом потенциальная энергия шага переходит в теплоту, 83% которой им усваивается. На сколько градусов нагреется при падении шар? Теплоемкость свинца cp =0,1256 кДж/(кг·К).
4.12. Какова должна быть скорость свинцовой пули, чтобы при ударе о стальную плиту она полностью расплавилась? Предполагается, что в момент удара температура пули равна 27ºC. Температура плавления свинца равна 327ºC, теплота плавления r пл=20,934 кДж/кг, а теплоемкость 0,1256 кДж/(кг·К).
4.13. Во время испытаний двигатель тормозится. На сколько градусов нагреется охлаждающая тормоз вода, если крутящий момент двигателя 5 кДж, а частота вращения 1500 об/мин? Известно, что к колодкам тормоза подводится 10 т/ч воды при температуре 15ºC. Предполагается, что вся работа двигателя превращается в теплоту трения.
4.14. Какое количество охлаждающей воды следует подавать на колодки испытательного тормоза в 1 ч, если мощность двигателя 55 кВт, температура охлаждающей воды 15ºC, а предельно допустимая температура воды на выходе 78ºC, причем 25% теплоты трения рассеивается в окружающей среде?
4.15. При торможении двигателя охлаждающая тормозные колодки вода нагревается на 25 К. Расход воды равен 1650 кг/ч. Определить мощность двигателя, если 30% теплоты трения рассеивается в окружающей среде.
4.16. Какова стоимость энергии, необходимой для того, чтобы поднять 2 т оборудования на вершину телевизионной башни высотой 516 м, если цена электроэнергии составляет 2,5 руб/(кВт·ч), а к.п.д. подъемного крана η=0,86?
4.17. На сжатие 3 кг метана (CH4) затрачено 800 кДж работы, при этом внутренняя энергия газа увеличилась на 595 кДж. Определить количество тепла и указать, подводится оно или отводится; определить изменение температуры и энтальпии газа, если мольная теплоемкость метана при постоянном объеме равна 26,48 кДж/(кмоль·град).
4.18. Определить изменение внутренней энергии стального стержня диаметром 20 мм, нагруженного постоянной растягивающей силой 0,3 МН, при изменении его температуры от 0 до 20ºС. Коэффициент линейного расширения стали 1,3·10-5 град-1, теплоемкость 0,46 кДж/(кг·К), плотность 7800 кг/м3. Работой стержня против сил атмосферного давления пренебречь.
4.19. В калориметрической бомбе емкостью 300 см3, заполненной кислородом при давлении 25 бар и температуре 20ºC, сгорает 0,3 г топлива, имеющего теплотворную способность 25100 кДж /кг. Определить повышение давления и температуру в конце сгорания, пренебрегая теплоотдачей к стенкам бомбы.
4.20. Шарообразный газгольдер диаметром 8 м заполнен природным газом (метаном – СН4) при давлении 1,5 бар и температуре 0ºC. Определить повышение давления в газгольдере и изменение внутренней энергии газа, когда в результате нагрева солнечными лучами температура газа повысится до 293 К. Известная мольная теплоемкость метана при постоянном давлении μ сp =34,7 кДж/(кмоль·К).
4.21. Избыточное давление водорода, находящегося в баллоне емкостью 40 л, в результате нагревания баллона повысилось с 140,3 бар до 15,2 МПа. Определить количество тепла, полученное водородом, и изменение его температуры, внутренней энергии и энтальпии, если начальная температура 17ºC, теплоемкость cp =14,05 кДж/(кг·K). Барометрическое давление составляет 743 мм рт.ст.
4.22. В цилиндре двигателя автомобиля «Волга» к концу хода сжатия объем рабочей смеси составляет 109 см3, температура 327ºC, давление 13 бар. Определить теоретическую температуру и давление после сгорания смеси, считая, что горение происходит мгновенно, а физические свойства смеси такие же, как у воздуха. Количество сгорающего топлива 19 мг, его теплотворная способность 43800 кДж/кг.
4.23. Вычислить средние массовую и объемную теплоемкости окиси углерода при постоянном объеме для интервала температур 0 – 1200ºC, если известно, что  для окиси углерода равно 32,192 кДж/(кмоль·К).
для окиси углерода равно 32,192 кДж/(кмоль·К).
4.24. Вычислить среднюю теплоемкость  для воздуха при постоянном давлении в пределах 200 – 800ºC, считая зависимость теплоемкости от температуры нелинейной. Решить эту же задачу, считая зависимость теплоемкости от температуры линейной.
для воздуха при постоянном давлении в пределах 200 – 800ºC, считая зависимость теплоемкости от температуры нелинейной. Решить эту же задачу, считая зависимость теплоемкости от температуры линейной.
4.25. Вычислить среднюю массовую теплоемкость при постоянном объеме для азота в пределах 200 – 800ºC, считая зависимость теплоемкости от температуры нелинейной. Решить эту же задачу, если известно, что средняя мольная теплоемкость азота при постоянном давлении может быть определена по формуле 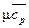 =28,7340+0,0023488 Т.
=28,7340+0,0023488 Т.
4.26. В закрытом сосуде объемом 300 л находится воздух при давлении P =8 бар и температуре t =20ºC. Какое количество тепла необходимо подвести для того, чтобы температура воздуха поднялась до 120ºC?
4.27. В компрессоре газовой турбины сжимается воздух. Начальная температура воздуха t 1=30ºC, температура после сжатия t 2=150ºC. Определить изменение энтальпии и внутренней энергии воздуха в процессе сжатия.
4.28. В регенеративном подогревателе газовой турбины воздух нагревается при постоянном давлении от t 1=130ºC до t 2=500ºC. Определить количество теплоты, сообщенное воздуху в единицу времени, если расход его составляет 250 кг/ч. Ответ дать в кДж/с и в киловаттах.
4.29. Баллон с водородом выносится из помещения с температурой 5ºC в машинный зал, где температура 25ºC. Найти количество теплоты, полученной газом после выравнивания температуры, если начальное давление в баллоне составляло 12 МПа. Объем баллона 40 дм3. Определить изменение энтальпии водорода.
4.30. Воздух выходит из компрессора при P =0,7 МПа и t = 160ºC и поступает в холодильник. На выходе из холодильника температура воздуха равна 25ºC. Определить количество теплоты, отданное охлаждающей воде в течение часа, если производительность компрессора 6 м3/мин.
4.31. При определении средней изобарной теплоемкости воздуха используется прямоточный калориметр с электрическим нагревателем. Определить среднюю массовую теплоемкость воздуха  , протекающего через калориметр, если при включении электрического нагревателя сила тока составляет 25 А, напряжение питания 36 В. Разность температур воздуха до и после нагревателя 18 К. Расход воздуха через калориметр 0,00055 м3/с, давление 750 мм рт. ст., температура воздуха, поступающего в калориметр, 297 К.
, протекающего через калориметр, если при включении электрического нагревателя сила тока составляет 25 А, напряжение питания 36 В. Разность температур воздуха до и после нагревателя 18 К. Расход воздуха через калориметр 0,00055 м3/с, давление 750 мм рт. ст., температура воздуха, поступающего в калориметр, 297 К.
4.32. В сосуде объемом 300 л находится кислород (О2) при давлении 2 бар и температуре 20ºC. Какое количество тепла необходимо подвести, чтобы температура кислорода повысилась до 300ºC? Какое давление установится при этом в сосуде?
4.33. В регенеративном подогревателе газовой турбины воздух нагревается от 170 до 580ºС. Определить количество тепла, сообщенное воздуху в единицу времени, если его расход составляет 350 кг/ч.
4.34. В калориметре с идеальной тепловой изоляцией находится вода в количестве M в=0,8 кг при температуре t 1=15ºC. Калориметр изготовлен из серебра, теплоемкость которого сv =0,2345 кДж/(кг·К). Масса калориметра M К=0,25 кг. В калориметр опускают 200 г алюминия при температуре t A=100ºC. В результате этого температура воды повышается до t 2=19,25ºC. Определить теплоемкость алюминия.
Дата добавления: 2015-10-29; просмотров: 1752 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Первый закон термодинамики | | | Процессы изменения состояния идеальных газов |