
Читайте также:
|
ЗАДАНИЕ 1. Проанализируйте, систематизируйте по назначению основные требования GМP, которым должны соответствовать предприятия, выпускающие фармацевтическую продукцию и запишите в таблицу 1.
Таблица 1
 Основные требования GMP Основные требования GMP
| 1. |
| 2. | |
| 3. | |
| 4. | |
| 5. | |
| 6. | |
| 7. | |
| 8. | |
| 9. | |
| 10. |
ЗАДАНИЕ 2. Проанализируйте, систематизируйте по назначению основные требования GМP к чистым помещениям, которым должны соответствовать предприятия, выпускающие фармацевтическую продукцию и запишите в таблицу 2.
Таблица 2
| Требования GМP к чистым помещениям | · |
| · | |
| · | |
| · | |
| · | |
| · | |
| · | |
| · | |
| · | |
| · |
ЗАДАНИЕ 3. Изучите определения основных терминов, изложенных в данной теме, подберите правильные ответы и запишите их в табл. 3
Таблица 3
| Надлежащая производственная практика | |
| Уполномоченное лицо | |
| Чистая зона | |
| Квалификация оборудования | |
| Класс чистоты | |
| Валидация | |
| Аэрозольная частица | |
| Задачи контроля качества | |
| Чистое помещение | |
| Рекламации |
ЗАДАНИЕ 4. С истематизируйте указанные документы по соответствующим уровням значимости и запишите в пирамиду:
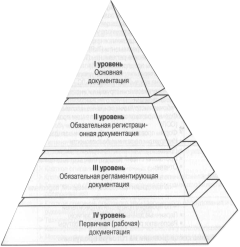
| 1. Аналитическая нормативная документация (АНД) 2.Досье на каждый выпускаемый ЛС 3.Инструкции по технике безопасности 4. Общеорганизационные инструкции по системе качества 5.Основной план валидации. Досье производственного участка 6. Отчеты: 7. Первичные данные (журналы, записи) 8. Протоколы производства серии и упаковки продукции 9. Протоколы стадий (маршрутные карты, операционные листы) 10. Рабочие инструкции (основные и вспомогательные) 11. Распечатки регистрирующей аппаратуры 12. Руководство по качеству - по валидации процессов, помещений, персонала - по валификации оборудования - по инспекции поставщиков - по проверке претензий потребителей 13. Спецификации 14. Стандарты предприятия (СТП) 15. Стратегический план развития предприятия 16. Технические регламенты (ТхР) качества 17. Технологические инструкции и инструкции по упаковке 18. Технологические регламенты (ТР) 19. Формы протоколов для регистрации проведения процессов (СОП) 20. Формы протоколов квалификации и валидации |
Литература
- Основная
- Лекция на тему: ”Надлежащая производственная практика (GМP)”
- Левашова И.Г., Мурашко А.Н., Подпружников Ю.В. Надлежащие практики в фармации: Учебник /Под ред.. В.П.Черных, С.Н.Коваленко.-К.:Морион, 2006.-256 с.
- Хрестоматия надлежащих фармацевтических практик/Под ред.С.Н.Коваленко, А.Н.Мурашко, И.Г.Левашовой.-Х.:Изд-во НФаУ, 2006.-295 с.
Тема.7 „Надлежащая практика хранения (GSP)”- 4 часа
1. Цель: систематизировать знания и приобрести практические навыки относительно стандартов хранения, транспортировки и распространения лекарственных препаратов в соответствии с Надлежащими практиками GSP.
Контрольные вопросы
1. Назначение и основные требования Руководства по надлежащей практике хранения фармацевтической продукции
2. Нормативно правовые документы, которые регламентируют хранение фармацевтической продукции в Украине
3. Виды складских помещений и основные требования к ним.
4. Характеристика оснащения складских помещений
5. Организационная структура складских помещений соответственно Руководства GSP
6. Категории хранения ЛС на складах соответствии с Руководством GSP
7. Контроль условий хранения ЛС на складах в соответствии с Руководством GSP
8. Общие требования систематизации ЛС в процессе их хранения на складах
9. Особенности хранения лекарственного растительного сырья на складах
10. Письменные инструкции и отчеты на складах в процессе хранения ЛС
11. Маркировка продукции в складских помещениях в соответствии с Руководством GSP
12. Возврат, отправка и транспортировка фармацевтической продукции со склада
13. Сертификация товарных складов в Украине
Дата добавления: 2015-08-21; просмотров: 124 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Основные требования GMP | | | Теоретический материал |