
|
Читайте также: |
Тоңазытқыш машиналардың айналмаларын есептегенде тоңазытқыш заттың параметрлерін анықтау қажет болады. Ол үшін түрлі кестелер, аналитикалық формулалар қолданылады. Тоңазыту техникасында бұл үшін көбінесе жылулық диаграммалар қолданылады. Себебі жылулық диаграмма арқылы тоңазытқыш заттың параметрлерін кез келген күйінде және дәлірек анықтауға болады. Жылулық диаграммаларын тәжірибе жүзінде анықталған параметрлер мәндері арқылы тұрғызылған. Тоңазыту техникасында жиі қолданылатын диаграммаларға Т-S және lgP – і диаграммалары жатады.
Т-S диаграммасы (1- сурет). Бұл диаграммада абцисса осьіне энтропианың мәні, ал ордината осіне температура мәндері салынады. Осы адиабаталар мен изотермалар құрайтын торға қаныққан сұйық пен қаныққан бу доғалары салынған. Бұл доғалар координата жазықтығын үш аймаққа бөледі. Қаныққан сұйықтар доғасының сол жағынджа заттың сүйық күйлеріне сәйкес келетін аймақ (1), қаныққан бу доғасының оң жағында заттың газ күйлеріне сәйкес орналасқан аймақ (3) жатады. Екі доғаның арасында заттың ылғалды бу күйін сипаттайтын аймақ (2) орналасқан.
Сонымен қайнау доғасы заттың сұйық күйі мен ылғалды бу күйінің шекарасы, ал булану доғасы заттың ылғалды бу күйі мен газ
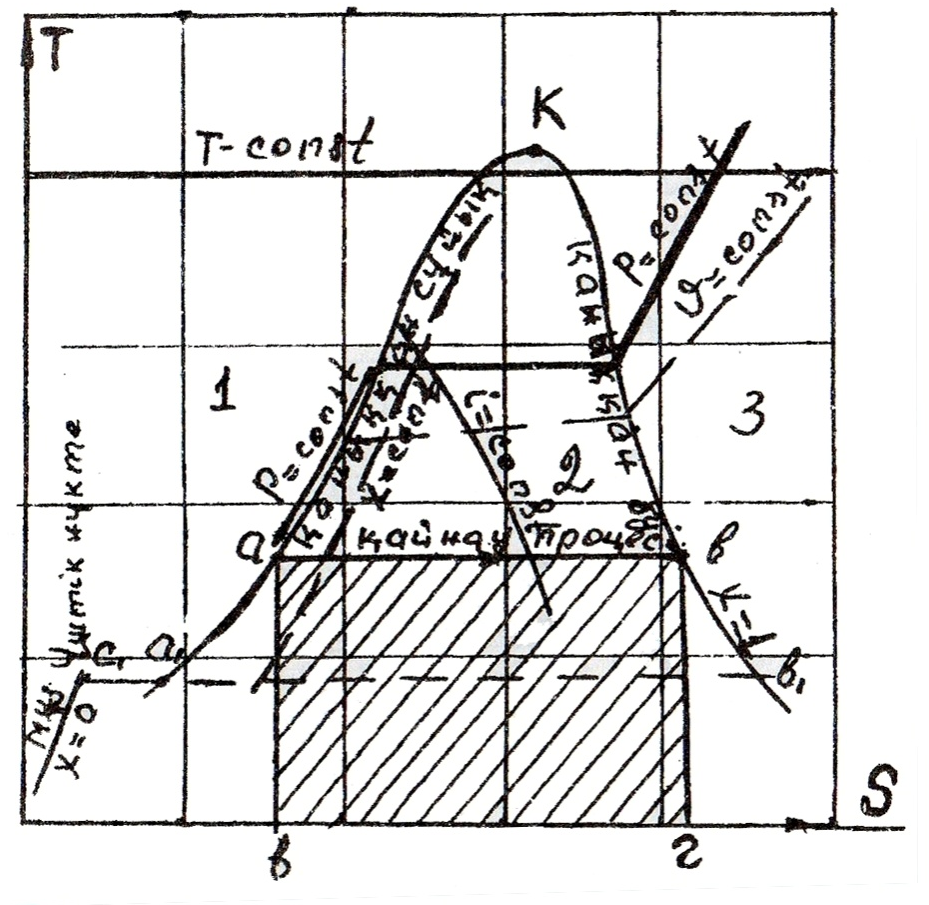
1- сурет.Т-S диаграммасы
күйінің шекарасы болып табылады. Бұл диаграммада тұрақты қысымды P (изобара), көлемді υ (изохора, энтальпияны i (изоэнтальпия), тұрақты бу ұстамдылықты (χ) көрсететін сызықтар келтірілген. Ылғалды бу аймағында изобара мен изотермия (таза зат үшін) бір деңгейлі сызықпен көрсетіледі. (Себебі қайнау кезінде заттың қысымы мен температурасы өзгермейді.) Бұл диаграммада затқа келтірілген, не заттан алынған жылу мөлшері ауданмен кескінделеді. Мысалы денеге a,b құбылысында келтірілген жылу (қайнау) а-б-в-г ауданымен кескінделеді (dq=TdS).
Бұл диаграммада абцисса осіне энтальпия мәні салынады. Диаграмманың ордината осін төмендету үшін қысым логарифмдік болып табылады. Бұл диаграммада да заттың әр түрлі күйлерін көрсететін үш аймақ бар: 1- сұйықтықтар аймағы, 2- ылғалды бу аймағы, 3- газ аймағы. lgP-i диаграммасы (2-сурет).
Қайнау (І), булану (ІІ) доғаларымен бірге тұрақты температура t (изотермия), меншікті көлем υ (изохора), энтропия S (изоэнтропия) сызықтары келтірілген. lgP-i диаграммасының T-S диаграммадан артықшылығы денеге берілген не одан алынған жылу ауданмен емес,
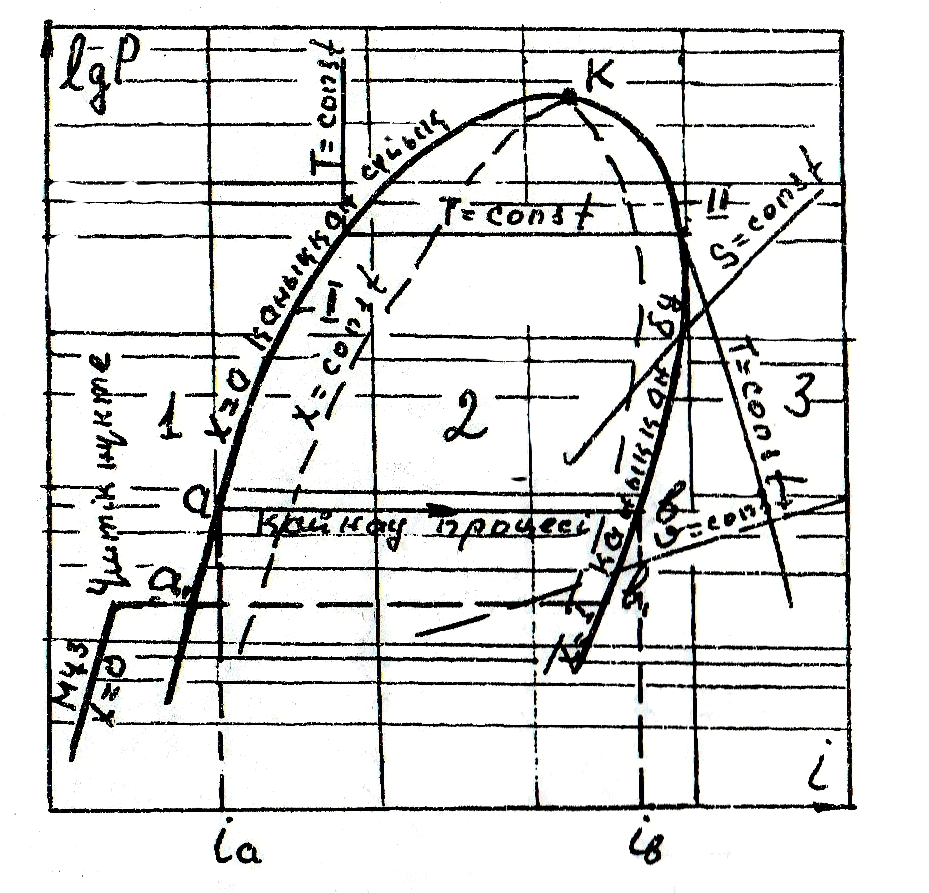
2- сурет. lgP- i диаграммасы
абцисса осіндегі түзу кесінділермен анықталады. Денеге берілген не денеден алынған жұмыс осылайша анықталады.
Мысалы: а-в процесінде келтірілген жылу (қайнау жылуы) ib-ia- түзу кесіндісімен есептеледі.
Жылу диаграммалары заттың белгілі екі параметрі арқылы қалған кез- келген параметрлерін анықтауға мүмкіндік береді. Сонымен қатар, жылу диаграммалары арқылы түрлі құбылыстарды (қайнау, сұйылу, қыздыру, сұйыту, қысу, дроссельдеу т.б) өрнектеуге болады.
Қайнау және булану доғалары K нүктесінде түйіседі. K–нүктесін критикалық нүкте деп атайды. Осы нүктеден жоғары аймақта зат тек газ күйінде ғана болуы мүмкін. Критикалық нүктеден төменгі аймақта зат бір температурада (қысымды) екі күйде болуы мүмкін: сұйық күйде (а нүктеде) және бу күйінде (в нүктеде). Ал айрықша бір параметрлерде зат үш түрлі күйде бола алады.(үш нүктеде). Қатты күйде (С1 нүктесінде), сұйық күйде (а 1 нүктесінде), бу (в1 нүктесінде) күйінде болады.
Тоңазытқыш заттар критикалық температурасы мен қысымының жоғары, ал үштік нүктедегі температурасы мен қысымының төмен мәндерімен сипатталады. Мысалы: R-12: Tкр = 384,5 К, Түш = 118 К.
Екі диаграммада да сұйықтар аймағында тұрақты көлемнің сызығы көрсетілмеген. Оның себебі сұйықтардың меншікті көлемі, будың меншікті көлемімен салыстырғанда өте аз. Сондықтан оларды диаграммада бір масштабта көрсету мүмкін емес. Оның үстіне сұйықтар қысылмайды. Сол себепті сұйықтар аймағында изобаралар көрсетілмейді, олар қайнау доғасымен бірігіп жатады.
Сұйықтардың меншікті көлемін тек қаныққан булардың кестесі арқылы анықтауға болады.
Дата добавления: 2015-10-23; просмотров: 336 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Температура бағаналары | | | Дроссельдеу процесі |