
Читайте также:
|
Жануды жылу бөлетін, тез өтетін химиялық өзгеріс деп қарастыру керек.Мұндай реакцияларды, жылуды жұтатын эндотермиялыққа қарағанда экзотермиялық деп атау дұрыс.Жану өнімдерінің қышқылдатқыштармен байланысып, жылуды бөлуі жылу үрдістерінде кең қолданылады. Жылу энергиясын қолданатын технологиялық үрдістерде жылуды еептеуде жанармай жану кезінде бөлінетін жылудың ролі зор.
Термодинамиканың бастамасына сәйкес, қабылдаушы өнім жүйесіне мына қатынас дұрыс::
Q= 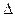 U+А = U
U+А = U 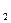 -U
-U 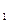 +A, (1-1)
+A, (1-1)
Мұнда Q —жүйеге келтірілген жылу; 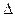 U= U
U= U 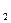 -U
-U 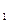 —жүйедегі ішкі энергияның өзгеруі; А — жүйені жиыруға не созуға жұмсалған жұмыс
—жүйедегі ішкі энергияның өзгеруі; А — жүйені жиыруға не созуға жұмсалған жұмыс
Термохимияда термодинамикаға қарағанда жүйеге жылу беру емес, керісінше жүйедене жылу бөліну дұрыс деп саналады: (1-1)

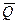 = U
= U 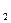 -U
-U 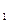 -A, (1-2)
-A, (1-2)
Мұнда Q —реакцияның жылулық эффектісі.
Жүйенің өзгеру қабілеті не қысмның барында не көлемнің барында өтетіні белгілі.Қысымның барында жүйені жиыру не созу келесі теңдеуден анықталады:
A=p(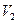 -
- 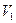 ) (1-3)
) (1-3)
Онда (1-2) формулаға сәйкес тепловой р = const, кезіндегі реакцияның жылу эффектісі келесі формуламен анықталуы мүмкін:
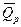 = U
= U 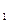 -U
-U 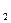 - p(
- p(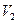 -
- 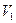 )=(U
)=(U 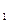 +p
+p 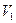 )-(U
)-(U 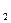 +p
+p 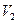 ) (1-4)
) (1-4)
Берілген жағдайда жылу сақтау:
I=U-pV, (1-5)
Онда (1-4) формуласын келесі түрде елестету қиын емес:
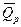 =
= 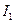 -
- 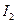 (1-6)
(1-6)
Формуладан қысыммен өтетін реакцияның жылу эффектісі қабылдағыш жүйедегі жылуды сақтау өзгерісіне тең екені белгілі.
Көлеммен өтетін кезде жиыру не созу жұмысы нөлге тең, онда (А = 0) және (1-2) формулалары басқа түрге көшеді:
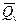 = U
= U 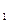 -U
-U 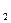 (1-7)
(1-7)
Демек, көлеммен өтетін реакция жылу эффектісі қабылдауыш жүйенің ішкі энергиясының өзгерісіне тең.
(1-4) және(1-7) мәндерін салыстыру рақасында келесі формуланы шығару қиын емес:
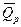 =
= 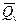 - p(
- p(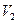 -
- 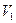 ), (1-8)
), (1-8)
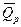 и
и 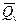 арасындағы айырмашылық, жүйенің ішкі қысымға қарсы жұмысы немесе ішкі қысмның жүйеге қарсы жұмысын білдіреді.көлемнің өзгересіз өткен кезде
арасындағы айырмашылық, жүйенің ішкі қысымға қарсы жұмысы немесе ішкі қысмның жүйеге қарсы жұмысын білдіреді.көлемнің өзгересіз өткен кезде 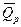 =
= 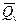 . Газдық қалыптағы теңдеуге тең Клапейрон формуласын (1-8) келесі түрде қабылдауға болады:
. Газдық қалыптағы теңдеуге тең Клапейрон формуласын (1-8) келесі түрде қабылдауға болады:
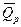 =
= 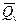 -
- 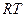 , (1-9)
, (1-9)
Мұнда R — Изобаралық қызу кеінде газбен атқарылатын жұмыс, газдық универсалды тұрақты.
Егер реакция көлемнің өзгеруімен өтсе, Авагадро заңына сәйкес мольдер саны тиісінше өзгереді.В Мұндай жағдайда (1-9) формуласы келесі түрде болады:
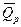 =
= 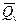 -
- 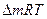 , (1-10)
, (1-10)
Мұнда 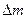 - реакцияға дейін және реакциядан кейнғі мольдер айырмашылығы, көлем өскенде
- реакцияға дейін және реакциядан кейнғі мольдер айырмашылығы, көлем өскенде 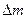 оң таңбалы болса, ал көлем кему кезінде теріс таңбалы болады.
оң таңбалы болса, ал көлем кему кезінде теріс таңбалы болады.
Химиялық реакция өтетін температура,  жылу эффектісіне әсерін тигізеді. (1-6) және (1-7) теңдеулерін тепе –теңдік сақтау кезінде по Т р= const и V= const, нәтижесінде мынаны аламыз:
жылу эффектісіне әсерін тигізеді. (1-6) және (1-7) теңдеулерін тепе –теңдік сақтау кезінде по Т р= const и V= const, нәтижесінде мынаны аламыз:
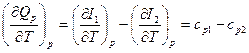 ; (1-11)
; (1-11)
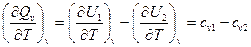 , (1-12)
, (1-12)
Мұнда 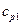 ,
, 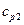 — р= const жылу сыйымдылықтың молярлық есебі,жанатын бастапқы өнімдер үшін;
— р= const жылу сыйымдылықтың молярлық есебі,жанатын бастапқы өнімдер үшін; 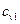 ,
, 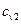 — V= const.
— V= const.
Бұл теңдеулер Кирхгоф заңын белгілейді, онда химиялық реакцияның жылу эффектісінің температуралық коэффиценті жанатын бастапқы өнімдердің жылу сыйымдылық айырмашылығына тең делінеді.Жанармайдың жануын қамтамасыз ететін реакциялардың көбіне, реакйияның жылу эффектісінің біраз пайызын құрайтын жану температурасы әсер етпейді.
(1-11) және (1-12) формулалары бойыншатемпературалық коэффицентті анықтағанда,температураға сәйкес келетін жылу эффектісінің мәнін табу қиын емес.
Жоғарыда келтірілген пікрлер жылу эффектісін жану үрдісімен де анықтауға болатынын көрсетеді. (қышқылдану). 1-1 кестесінде жану үрдісінде жылу эффектісін анықтайтын үрдістің негізгі термохимиялық теңдеулері берілген.
Дата добавления: 2015-10-23; просмотров: 324 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Жану өнімдерінің диссоциациясы | | | Химиялық тепе-теңдік. |