
|
Читайте также: |
Әрбір үрдіс, соның ішінде химиялық өзгеру үрдісі де уақыт аралығында өтеді. Химиялық реакциядағы бір бірлік уақыт ішіндегі қабылдаушы өнімдерді сипаттайды.
Қалыпты температурада өтетін қайтымды химиялық реакцияны қарастырайық,
aA + bB  cC + dD, (1-13)
cC + dD, (1-13)
1-1 кесте - Жану үрдісінде жылу эффектісін анықтайтын үрдістің негізгі термохимиялық теңдеулері

Мұнда А, В, С, D —қабылдаушы өнімдер; а, b, c, d — стехиометрлік коэффициенттер.
Тура бағыттағы реакция жылдамдығы мына формуламен анықталады:
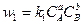 (1-14)
(1-14)
Кері бағытта да осы формула қолданылады:
 , (1-15)
, (1-15)
Мұнда  ,
, 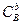 ,
,  ,
,  —қабылдаушы өнімдердің концентрациясы,молярлық үлес;
—қабылдаушы өнімдердің концентрациясы,молярлық үлес; 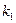 ,
,  — тура және кері реакциялардағы жылдамдық тұрақтылары.
— тура және кері реакциялардағы жылдамдық тұрақтылары.
Химиялық реакциялар екі бағытта да жүретін болғандықтан, тәжірибеде байқалатын реакция жылдамдықтары кері бағытта, бір уақытта өтетін химиялық өзгерістер жылдамдығы:
 . (1-16)
. (1-16)
Реакцияның даму қарқынына қарай оның жылдамдығы тура бағытта кемиді ал кері бағытта өседі. Сонымен бірге, екі бағыттағы реакция жылдамдығы бірдей болатын жағдайлар да болады. Бұл жағдайда бақыланатын жылдамдық нөлге тең, бірақ реакциядағы өнім қабылдағышы тоқталмайды. Жүйенің бұндай қалпы тепе-теңдік қалып деп аталады.
Тепе-теңдік қалыпқа формула мынадай күйде болады: (1-16)

 , (1-17)
, (1-17)
Осыдан
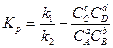 , (1-18)
, (1-18)
Мұнда 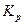 —тепе-теңдік тұрақтысы, Идеалды газда ол температурадан,ал шынайы газдарда ол қысымнан тәуелді болады;жеке мүшелер қатынасынан тұрақтылар мәні өзгермейді. (1-18) теңдеуі массалардың математикалық өрнегі, оған сәйкес реакция қабылдағыш өнімдердің концентрациясына пропорционал болады.
—тепе-теңдік тұрақтысы, Идеалды газда ол температурадан,ал шынайы газдарда ол қысымнан тәуелді болады;жеке мүшелер қатынасынан тұрақтылар мәні өзгермейді. (1-18) теңдеуі массалардың математикалық өрнегі, оған сәйкес реакция қабылдағыш өнімдердің концентрациясына пропорционал болады.
Тепе-теңдік тұрақтыларын жеке заттардың парциалды қысымымен белгілеу керек:
 , (1-19)
, (1-19)
Мұнда  ,
,  ,
,  ,
, 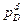 —заттын парциалды қысымы А, В, С и D.
—заттын парциалды қысымы А, В, С и D.
Жүйенің жалпы қысымы барлық газдардың соның ішінді реакцияға қатыспайтын газдардың да парциалды қысымдарының қосындысына тең.
Көлемдік- молярлық концентрация мен парциалды қысым арасындағы байланысты келесі түрде беруге болады:
 . (1-20)
. (1-20)
Онда (1-18)формуласы мына түрге әкеледі:
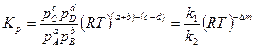 , (1-21)
, (1-21)
Мұнда  —Қабылдағыш заттардың мольдерінің өзгеру сандары.
—Қабылдағыш заттардың мольдерінің өзгеру сандары.
Жану реакциясына К мәндері кестеде келтірілген 1-2.
Кесте1-2 - Кейбір жану реакциясының тепе-теңдік константасының мәні
| Темпе ратура К | Жану реакциялары | |||
| 
| 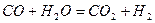
| 
| |
| 0,1825 · 10-44 0,9886 · 10-25 0,6331 · 10-10 0,5087 · 10-5 0,1371 · 10-2 0,3810 · 10-1 0,3417 | 0,1637 · 10-39 0,1302 · 10-22 0,8727 · 10-10 0,1885 · 10-5 0,2892 · 10-3 0,6037 · 10-2 0,4628 · 10-1 | 0,1115 · 10-4 0,7593 · 10-2 0,7254 2,6990 4,7410 6,3110 7,3820 | 0,5140 · 10-46 0,3518 · 10-26 0,3604 · 10-11 0,4016 · 10-6 0,1378 · 10-3 0,4625 · 10-2 0,4841 · 10-1 |
Ле Шателье жүйенің тепе- теңдігіне әсер ететін анықтаушы факторларды ұсынған (температура, қысым, т.б.). Ле Шательн тұжырымдамасының негізінде қарама-қайшылық принципі жатыр.Ле Шателье тұжырымдамасының мәні келесіде: тепе-теңдік жүйеге байланысты жүргізілетін әрбір іс тепе- теңдіктің ауытқуына әкеледі, ал ол өндіруші іске кері әсерін тигізеді. Бұл тұжырымды келесі мысалмен түсіндірейік.Химиялық белсенді газдардың тепе-теңдік күйін келтірейік:
 . (1-22)
. (1-22)
Егер жүйеге жылуды қосса, о яғни температураны жоғарлатса, онда тепе-теңдік жойылып, жылуды жұтатын реакция жаққа ығысады. Қарастырылатын жағдайда жылу беру реакцияны кері бағытта үдетеді деаммиактың бөлінуіне септігін тигізеді.Егер, жүйедегі қысымды өсірсе, онда реакция тура бағытта өрбиді, өйткені аммиак бөлінген кезде қысым кішірейеді.
Тепе-теңдіктің ығсуына сонымен бірге компоненттердің концентрациясының өзгеруі де әсер етеді. Реакция аймағынан қандай да бір бөліктің реакция үрдісінде көп болуына әсер етеді. Реакция аймағына қабылдаушы компоненттің біреуін енгізу, осы реакциядағы компоненттің пайда болуын тежейді.
Температурадан тепе-теңдік тұрақтысымен жылу эффектісінің тәуелділігі туралы анықтамасын Я.Х.Вахт-Гоффот теориялық формуланы шығарған.
 . (1-23)
. (1-23)
Бұл теңдеу В. Нернстпенреакция изохорасы деп аталған, өйткені ол жүйенің тепе-теңдігінің қалыпты қысымдағы температурадан тәуелділігін анықтайды.
(1-23) температура бойынша теңдеулерді қосқанда келесі тәуелділік шығады:
 2,3
2,3  . (1-24)
. (1-24)
Бұл жуық формула, өйткені температураның реакцияның жылу эффектісіне әсерін қарастырмайды  . Дәлдік керек жағдайда бұл тәуелділікті ескеру керек. Кирхгоф заңына сәйкес ол дәрежелік түрде берілуі мүмкін:
. Дәлдік керек жағдайда бұл тәуелділікті ескеру керек. Кирхгоф заңына сәйкес ол дәрежелік түрде берілуі мүмкін:
 … (1-25)
… (1-25)
Онда (1-23)былай болады:
 , (1-26)
, (1-26)
Осыдан
 (1-27)
(1-27)
Немесе
 . (1-28)
. (1-28)
Кез келген температурада тепе-теңдік тұрақтысын анықтағанда теңдеулер тұрақтыларын да анықтауға болады.
Жоғарыда келтірілген теңдеулердің тәжірибелік мәні зор, өйткені олар реакция жылу эффектісін және бір тұрақтымен тепе-теңдік күйін анықтайды. 1-1кестеде жану реакциясының негізгі тепе-теңдік тұрақтылар теңдеуі келтірілген. Бұл мәндермен әртүрлі тепе-теңдік тұрақтыларды да анықтауға болады.
Температурамен қатар тепе-теңдік жағдайға қысым да әсер етеді. Жүйедегі қысымның өсуі өнімдердің қабылдағыштығын арттырады.
Бірақ жану реакциясына бұл әсер етпейді, өйткені 1200-2100К температурада жану реакциясы қысым төмендесе де аяғына, тіпті атмосфералыққа дейін жүреді.
Дата добавления: 2015-10-23; просмотров: 1050 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Жану үрдісінің физико-химиялық және термодинамикалық негізі. Жану үрдісінің жылу әсері | | | Газдық жану реакциясының кинетикасы |