
Читайте также:
|
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:

Константа этого равновесия рассчитывается по уравнению:

В приближении идеального раствора с учётом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:

Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:
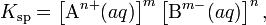
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1·10−4 моль/л необходимо использовать произведение активностей:
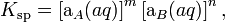
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
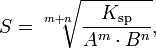
где:
m+n — суммарное количество молей катионов и анионов
m — количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
Дата добавления: 2015-09-01; просмотров: 60 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Растворы электролитов. Теория Аррениуса. Диссоциация кислот, солей, оснований. Степень электролитической диссоциации. | | | Ионное произведение воды. Водородный показатель. |