
Читайте также:
|
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:

Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:

где:
· [H+] — концентрация ионов гидроксония (протонов);
· [OH−] — концентрация гидроксид-ионов;
· [H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:

Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
В чистой воде при 25 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определенияионного произведения воды
, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 25 °C).Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−] говорят, что раствор является кислым, а при [OH−] > [H+] — щелочным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентраций ионов водорода пользуются их десятичным логарифмом, взятым с обратным знаком, который собственно и является водородным показателем — pH.

POH
Несколько меньшее распространение получила обратная pH величина — показатель основности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:

как в любом водном растворе при 22 °C  , очевидно, что при
, очевидно, что при
этой температуре:

Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10−15 моль /л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH = −1.
Так как при 25 °C (стандартных условиях)[H+] · [OH−] = 10−14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислых растворах [H+] > 10−7, то у кислых растворов pH < 7, аналогично, у щелочных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.
34. Гидролиз солей. Константы гидролиза. Степень гидролиза. Буферные растворы. Буферное действие. Буферная ёмкость.
Различают обратимый и необратимый гидролиз солей [1] :
· 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
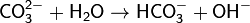

(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
· 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):


(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
· 3. Гидролиз соли слабой кислоты и слабого основания:


(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (c гидр/ c общ)·100 %
где c гидр — число молей гидролизованной соли, c общ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
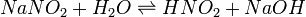

Уравнение константы равновесия для данной реакции имеет вид:
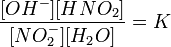 или
или 
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных  можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:

Численное значение константы гидролиза получим, используя ионное произведение воды  и константу диссоциацииазотистой кислоты
и константу диссоциацииазотистой кислоты  :
:


подставим в уравнение константы гидролиза равна:

В общем случае для соли, образованной слабой кислотой и сильным основанием:
 , где
, где  — константа диссоциации слабой кислоты, образующейся при гидролизе
— константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
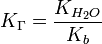 , где
, где  — константа диссоциации слабого основания, образующегося при гидролизе
— константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:

Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.

|
Примером Б. с. служит смесь растворов уксусной кислоты CH3COOH и её натриевой соли CH3COONa. Эта соль как сильный электролит диссоциирует практически нацело, т. е. даёт много ионов CH3COO-. При добавлении к Б. с. сильной кислоты, дающей много ионов Н+, эти ионы связываются ионами CH3COO- и образуют слабую (то есть мало диссоциирующую) уксусную кислоту:
Наоборот, при подщелачивании Б. с., то есть при добавлении сильного основания (например, NaOH), ионы OH- связываются Н+-ионами, имеющимися в Б. с. благодаря диссоциации уксусной кислоты; при этом образуется очень слабый электролит — вода:

|
По мере расходования Н+-ионов на связывание ионов OH- диссоциируют всё новые и новые молекулы CH3COOH, так что равновесие (1) смещается влево. В результате, как в случае добавления Н+-ионов, так и в случае добавления ОН--ионов, эти ионы связываются и потому кислотность раствора практически не меняется.
Кислотность растворов принято выражать так называемым водородным показателем pH (для нейтральных растворов pH=7, для кислых — pH меньше, а для щелочных — больше 7). Приливание к 1 л чистой воды 100 мл 0,01 молярного раствора HCl (0,01 М) изменяет pH от 7 до 3. Приливание того же раствора к 1 л Б. с. CH3COOH + CH3COONa (0,1 М)изменит pH от 4,7 до 4,65, то есть всего на 0,05. В присутствии 100 мл 0,01 М раствора NaOH в чистой воде pH изменится от 7 до 11, а в указанной Б. с. лишь от 4,7 до 4,8. Кроме рассмотренного, имеются многочисленные другие Б. с. (примеры см. в табл.). Кислотность (и, следовательно, pH) Б. с. зависит от природы компонентов, их концентрации, а для некоторых Б. с. и от температуры. Для каждой Б. с. pH остаётся примерно постоянным лишь до определённого предела, зависящего от концентрации компонентов.
Примеры буферных систем
| Компоненты (концентрации по 0,1 г мол/л) | pH (при 15—250C) |
| Уксусная кислота + ацетат натрия, CH3COOH + CH3COONa | 4,7 |
| Лимоннокислый натрий (двузамещеный), C6H6O7Na2 | 5,0 |
| Борная кислота + бура, Н3ВО3 + Na2B4O7 10H2O | 8,5 |
| Борная кислота + едкий натр, Н3ВО3 + NaOH. | 9,2 |
| Фосфат натрия (двузамещеный)+ + едкий натр, Na2HPO4 + NaOH | 11,5 |
Б. с. широко используются в аналитической практике и в химическом производстве, так как многие химические реакции идут в нужном направлении и с достаточной скоростью лишь в узких пределах pH. Б. с. имеют важнейшее значение для жизнедеятельности организмов; они определяют постоянство кислотности различных биологических жидкостей (крови, лимфы, межклеточных жидкостей). Основные Б. с. организма животных и человека: бикарбонатная (угольная кислота и её соли), фосфатная (фосфорная кислота и её соли), белки (их буферные свойства определяются наличием основных и кислотных групп). Белки крови (прежде всего гемоглобин, обусловливающий около 75% буферной способности крови) обеспечивают относительную устойчивость pH крови. У человека pH крови равен 7,35—7,47 и сохраняется в этих пределах даже при значительных изменениях питания и др. условий. Чтобы сдвинуть pH крови в щелочную сторону, необходимо добавить к ней в 40—70 раз больше щёлочи, чем к равному объёму чистой воды. Естественные Б. с. в почве играют большую роль в сохранении плодородия полей.
Дата добавления: 2015-09-01; просмотров: 266 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Произведение растворимости. | | | Способы выражения концентрации растворов. |