
Читайте также:
|
Закон Гесса: (1836 г) тепловой эффект хим.реакции зависит от состояния исходных веществ и конечных продуктов, но независит от промежуточных стадий реакции
Следствие:
Закон Гесса может быть записан в виде следующего математического выражения:
 .
.
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально.
Энтропия — в естественных науках мера беспорядка системы, состоящей из многих элементов. Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
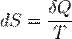 , где
, где  — приращение энтропии;
— приращение энтропии;  — минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
— минимальная теплота, подведенная к системе; T — абсолютная температура процесса;
Изобарно-изотермический потенциал.
1. Стремление частиц объединиться в более сложные, что уменьшает энтальпию.
2. Стремление частиц разъединиться, увеличить беспорядок, что увеличивает энтропию.
Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянной температуре и постоянном давлении, отражает изменение изобарно-изотермического (или для краткости - изобарного) потенциала ΔG: ΔG = ΔН – TΔS,
где ΔН - изменение эптальпии (теплосодержания системы), кДж/моль;
ΔS - изменение энтропии (меры беспорядка систем), Дж/моль•К;
T - температура, К.
Изобарный потенциал измеряется в ккал/моль или кДж/моль.
Характер изменений ΔG позволяет судить о принципиальной возможности или невозможности протекания процесса:
Если ΔG < 0, т. е. изобарный потенциал в ходе реакции уменьшается, то процесс возможен и, начавшись, он протекает самопроизвольно (спонтанно).
Если ΔG > 0, то невозможно осуществить процесс в данных условиях.
Если ΔG = 0, наблюдается состояние химического равновесия.
25. Растворимость. Растворимость твёрдых, жидких и газообразных веществ в воде. Тепловые явления при растворении. Закон Генри.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.
Закон описан английским химиком У. Генри в 1803 г.
Дата добавления: 2015-09-01; просмотров: 192 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Термохимия. Термохимические уравнения. Стандартная теплота образования. | | | Теория растворов. Сольваты. Гидраты. Насыщенные, ненасыщенные, пересыщенные растворы. |