
|
Читайте также: |
Химическая кинетика трактует качественные и количественные изменения в ходе химического процесса, происходящие во времени. Обычно эту общую задачу подразделяют на две более конкретные:
1) выявление механизма реакции — установление элементарных стадий процесса и последовательности их протекания (качественные изменения);
2) количественное описание химической реакции — установление строгих соотношений, которые могли бы удовлетворительно предсказывать изменения количеств исходных реагентов и продуктов по мере протекания реакции.
Также в зависимости от необходимости нахождения концентрации веществ по схеме реакции либо восстановление схемы по известным концентрациям ставится задача прямая или обратная.
1) Под прямой задачей химической кинетики понимают задачу нахождения концентраций участвующих в реакции веществ в любой момент времени, исходя из известных начальных концентраций, схемы реакции и констант скоростей отдельных стадий.
2) Обратная задача химической кинетики — восстановление по известной зависимости концентрации веществ от времени схемы реакции и констант скорости.
КИНЕТИЧЕСКОЕ УРАВНЕНИЕ, выражает зависимость скорости хим. р-ции от концентраций компонентов реакц. смеси. Для простой (одностадийной) гомог. р-ции скорость v пропорциональна произведению концентраций реагирующих в-в и кинетическое уравнение записывается в виде:

где [Ai] (i=1,2,...,l) - концентрация i-го в-ва, ni-порядок реакции по i-му в-ву, k-константа скорости р-ции.
МОЛЕКУЛЯРНОСТЬ РЕАКЦИИ, число частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) р-ции и превращающихся в продукты. Так, для р-ций в р-рах молекулярность реакции не учитывает число молекул р-рителя, образующих сольватную оболочку или мол. комплексы с реагентами, т. к. эти молекулы не входят в состав продуктов р-ции. В р-циях замещения и элиминирования орг. соед., протекающих часто в неск. стадий, молекулярность реакции оценивается как число молекул, претерпевающих хим. превращение в лимитирующей стадии. Соответственно числу реагирующих частиц различают мономолекулярные реакции, бимолекулярные реакции и тримолекулярные реакции, отличающиеся кинетич. закономерностями и механизмом. Как правило, молекуляр-ность простой р-ции совпадает с порядком реакции, однако бывают и несовпадения. Напр., рекомбинации атомов в газовой фазе протекают через тройные столкновения типа 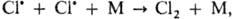 где М-третья частица. Суммарный порядок таких р-ций-третий (скорость u = = k[М][Сl]2, где k-константа скорости), но молекуляр-ность равна 2, т.к. в хим. взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом хим. превращения.
где М-третья частица. Суммарный порядок таких р-ций-третий (скорость u = = k[М][Сl]2, где k-константа скорости), но молекуляр-ность равна 2, т.к. в хим. взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом хим. превращения.
Дата добавления: 2015-09-01; просмотров: 82 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Водородная связь. | | | Скорость химической реакции. Факторы, влияющие на скорость реакции. |