
Читайте также:
|
Основания Бренстеда – нейтральные молекулы или ионы, способные принимать протон. Для образования ковалентной связи с протоном в молекуле должны присутствовать электроны p-связи (p-электроны) или неподеленная пара электронов на несвязывающей молекулярной орбитали (n-электроны). Основность – мера способности атома присоединять протон.
В зависимости от названия ионов, которые образуются в результате присоединения протона к центру основности, n-основания Бренстеда делятся на:
1) аммониевые основания,
2) оксониевые основания
3) сульфониевые основания,
4) фосфониевые основания,
5) карбониевые основания.
p-Основания (алкены, алкины, арены) – слабые основания, так как протонизируемые электронные пары не свободны, находятся на связывающей молекулярной орбитали.
Для количественной оценки основности используют рКа сопряженных с ними кислот, обозначаемую символом рКBH+. Чем выше значение рКвн+, тем выше основнось.
При качественном сравнении основности соединений сопоставляют относительную стабильность сопряженных кислот (катионов). Чем стабильнее катион, тем сильнее основание. Стабильность катиона зависит от степени делокализации его положительного заряда, то есть величины положительного заряда на атоме – центре основности.
Стабильность катиона (для элементов одного периода) определяется:
1) электроотрицательностью,
2) электронными эффектами,
3) эффектом сольватации,
4) стерическим эффектом.
Электроотрицательность зависит не только от величины заряда ядра, но и от вида гибридизации атомных орбиталей. Для одного и того же элемента она увеличивается в следующем ряду:
ЭОsp3< ЭОsp2< ЭОsp.
Собственная основность соединения (в газовой фазе) определяется электронными факторами:
1) чем выше электроотрицательность, тем ниже основность;
2) электронодонорные заместители уменьшают положительный заряд катиона, стабилизируют катион и, следовательно, повышают основность основания;
3) электроноакцепторные заместители повышают положительный заряд, дестабилизируют катион, понижают основность.
Этап 1. Согласно общему подходу для качественного сравнения собственной основности рассматриваемых соединений сопоставим стабильность в газовой фазе их сопряженных кислот:
 Основное отличие катионов заключается в наличии фенильных радикалов и их количестве. Фенильные радикалы, связанные с sp3- гибридизованным положительно заряженным атомом азота, проявляют положительный индуктивный эффект (+I), являются электронодонорами, стабилизируя катион. При этом чем больше таких заместителей, тем выше степень делокализации положительного заряда, тем стабильнее катион и выше основность амина. Поэтому в газовой фазе наиболее сильным основанием является трифениламин, а основность остальных соединений падает с уменьшением количества заместителей.
Основное отличие катионов заключается в наличии фенильных радикалов и их количестве. Фенильные радикалы, связанные с sp3- гибридизованным положительно заряженным атомом азота, проявляют положительный индуктивный эффект (+I), являются электронодонорами, стабилизируя катион. При этом чем больше таких заместителей, тем выше степень делокализации положительного заряда, тем стабильнее катион и выше основность амина. Поэтому в газовой фазе наиболее сильным основанием является трифениламин, а основность остальных соединений падает с уменьшением количества заместителей.
Этап 2. В водной фазе эффект сольватации рассматриваемых катионов будет тем выше, чем меньше их размер и менее делокализован положительный заряд. Поэтому энергия сольватации иона незамещенного аммония будет значительно больше, чем других ионов.
Таким образом, ион аммония  в воде более стабилен и энергетичски более выгоден, чем остальные ионы, стабильность которых падает с увеличением числа фенильных групп, стерически препятствующих сольватации.
в воде более стабилен и энергетичски более выгоден, чем остальные ионы, стабильность которых падает с увеличением числа фенильных групп, стерически препятствующих сольватации.

Падение стабильности катионов в воде.
Поскольку рассматриваемые катионы по размеру значительно отличаются друг от друга, энергетический вклад эффекта сольватации будет больше, чем электронных эффектов. В результате относительная основность в растворе рассматриваемых соединений будет уменьшаться в том же направлении, что и стабильность катионов в водной среде.
Заключение.
1. Относительная основность аммониевых оснований Бренстеда в газовой фазе уменьшается в следующем порядке:
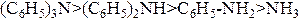
2. В водном растворе в результате доминирующего эффекта сольватации происходит обращение ряда основности:
 ,
,
что подтверждается экспериментальными данными
Дата добавления: 2015-07-20; просмотров: 122 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение | | | Решение. |