
Читайте также:
|
Общий подход. Для качественного сравнения кислотности предложенных соединений следует сопоставить стабильность соответствующих им сопряженных оснований – анионов. В данных соединениях с кислотными центрами (СН, NH, OH, SH) связан один и тот же метильный радикал. Его вклад в стабилизацию анионов будет одинаков и поэтому может не учитываться. В результате стабильность анионов будет зависеть главным образом от элекроотрицательности и поляризуемости атомов в кислотном центре.
Для кислот Бренстеда с атомом одного периода в кислотном центре определяющим фактором стабилизации анионов является электроотрицательность. Чем выше электроотрицательность атома, тем меньше его отрицательный заряд, тем стабильнее анион и выше кислотность.
В случае кислот Бренстеда с атомами разных периодов в кислотном центре главную роль в стабилизации аниона играет поляризуемость атома (его способность делокализовать отрицательный заряд в большем объеме). Чем выше поляризуемость атома, тем стабильнее анион и выше кислотность.
Этап 1. Напишем сравниваемые анионы:
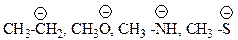
В трех первых анионах отрицательный заряд сосредоточен на атомах элементов одного периода (C,N,O). Следовательно, стабильность этих анионов будет определяться электроотрицательностью этих атомов. Согласно шкале Полинга электроотрицательность уменьшается в ряду О>N>C. В этом же порядке уменьшается и стабильность анионов:

Таким образом, по уменьшению кислотности рассматриваемые соединения располагаются в следующий ряд:
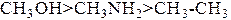 .
.
Этап 2. Для оценки кислотности метантиола рассмотрим стабильность метантиолят–иона 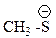 в сравнении с метоксид–ионом
в сравнении с метоксид–ионом  . Поскольку в сравниваемых ионах отрицательный заряд находится у атомов разных периодов, стабильность этих анионов определяется не электроотрицательностью, а поляризуемостью атома. Валентные орбитали атома серы расположены дальше от ядра и имеют больший размер, чем у атома кислорода. Поэтому отрицательный заряд на атоме серы делокализован в большей степени, что приводит к увеличению стабильности тиолят – иона по сравнению с
. Поскольку в сравниваемых ионах отрицательный заряд находится у атомов разных периодов, стабильность этих анионов определяется не электроотрицательностью, а поляризуемостью атома. Валентные орбитали атома серы расположены дальше от ядра и имеют больший размер, чем у атома кислорода. Поэтому отрицательный заряд на атоме серы делокализован в большей степени, что приводит к увеличению стабильности тиолят – иона по сравнению с  . Таким образом, метантиол является более сильной кислотой, чем метанол.
. Таким образом, метантиол является более сильной кислотой, чем метанол.
Заключение:
1.Как в газовой, так и в жидкой фазе кислотность рассматриваемых соединений уменьшается в ряду:
CH3SH>CH3OH>CH3NH2>CH3-CH3.
2.Для всех кислот Бренстеда с одинаковыми радикалами характерно уменьшение кислотности в следующем порядке:
SH>OH>NH>CH.
Обучающая задача №3.
Сравните основность аммиака, анилина, дифениламина и трифениламина в газовой фазе и воде.
Решение
Дата добавления: 2015-07-20; просмотров: 362 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Увеличение стабильности анионов в газовой фазе | | | Общий подход. |