
Читайте также:
|
Поскольку кислотный центр всех анионов одинаков, их стабильность определяется только влиянием алкильных радикалов, которые проявляют отрицательный индуктивный эффект и являются электроноакцепторами, так как они связаны с сильным электронодонорным отрицательно заряженным атомом кислорода. Таким образом, алкилы стабилизируют анионы и тем сильнее, чем длиннее и разветвленнее алкильный радикал. В связи с этим увеличение стабильности анионов происходит от  к
к  . Кислотность рассматриваемых кислот увеличивается в газовой фазе в той же последовательности, что и стабильность анионов.
. Кислотность рассматриваемых кислот увеличивается в газовой фазе в той же последовательности, что и стабильность анионов.
Этап 2. В жидкой фазе на устойчивость анионов влияет еще сольватация. При этом величина энергии сольватации тем больше, чем меньше ион по размеру и чем менее делокализован в нем заряд. Поэтому наиболее стабильным в жидкой фазе из рассматриваемых анионов будет гидроксид-ион 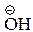 . Сольватация алкоксид-ионов будет уменьшаться с ростом объема радикала из-за стеричесикх препятствий сольватации и увеличения степени делокализации отрицательного заряда. Поскольку рассматриваемые ионы по размеру резко отличаются друг от друга, эффект сольватации в данном случае будет превосходить по силе электронные эффекты алкилов и определять последовательность изменения кислотности: чем меньше сольватация ионов, тем меньше кислотность соединений. Таким образом, главным фактором, определяющим относительную кислотность в растворе, является различие в сольватации анионов.
. Сольватация алкоксид-ионов будет уменьшаться с ростом объема радикала из-за стеричесикх препятствий сольватации и увеличения степени делокализации отрицательного заряда. Поскольку рассматриваемые ионы по размеру резко отличаются друг от друга, эффект сольватации в данном случае будет превосходить по силе электронные эффекты алкилов и определять последовательность изменения кислотности: чем меньше сольватация ионов, тем меньше кислотность соединений. Таким образом, главным фактором, определяющим относительную кислотность в растворе, является различие в сольватации анионов.
Заключение.
1. Кислотность рассматриваемых ОН-кислот в газовой фазе возрастает в следующем порядке:

2. В водном растворе происходит обращение ряда кислотности:
 , что подтверждается экспериментальными данными.
, что подтверждается экспериментальными данными.
Дата добавления: 2015-07-20; просмотров: 135 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Обучающая задача № 1. | | | Решение |