
Читайте также:
|
Оборудование и материалы:
пипетки на 25 см³, коническая колба – 100 см³, мерная колба – 250 см³, бюретка – 25 см³.
Реактивы:
5%-ныйр-р хромовокислого калия (K2 CrO4), 0,05 н раствор азотнокислого серебра (AgNO3).
Проведение испытания:
Из фильтрата (500 мл), полученного при определении нерастворимых в воде веществ, пипеткой перенести 5 мл в коническую колбу. Раствор разбавить дистиллированной водой до 50 мл и добавить 2 капли раствора хромово - кислого калия.
Раствор в конической колбе оттитровать раствором азотно-кислого серебра при взбалтывании содержимого в колбе до момента перехода окраски в слабый красновато - бурый цвет, не исчезающий при дальнейшем перемешивании. Титрование проводить на белом фоне.
Из количества (в мл), израсходованного на титрование азотно - кислого серебра (AgNO3) вычитают 0,1 мл (объем раствора азотнокислого серебра, необходимый для появления уловимой глазом окраски в растворе с индикатором, не содержащем хлор).
Массовую долю хлор - иона (Х4) в % определяют по формуле:
(V – 0,1) × k × 0,003546 × 500 × 100
Х4 = mc × 5, (4)
где: V – объем раствора азотнокислого серебра (AgNO3), израсходованный на титрование и уменьшенный на 0,1 мл, (V– 0,1) см³;;
k – коэффициент нормальности для 0,1 н раствора AgNO3; (=0,1)
0,003546 – масса хлор-иона, соответствующая 1 мл точно 0,1 н р-ра AgNO3;
500 – общий объем исходного раствора, мл;
5 – объем исходного раствора, взятый для определения хлора, мл.
mc – масса навески соли, в пересчете на сухое вещество, в г., которую вычисляют по формуле:
m × (100 – Х1)
mс = 100,
где: m - масса навески соли, г
Х1 – массовая доля влаги, % (п.3.1)
За окончательный результат анализа принимают среднее арифметическое двух параллельных определений, допускаемое расхождение между которыми не должно превышать 0,01%.
3.5. Определение массовой доли кальций-иона (Са²⁺)
Метод основан на способности ионов кальция образовывать окрашенный комплекс с трилоном «Б» в присутствии индикатора мурексида.
Мурексид «чистый» применяют в виде смеси с хлористым натрием в соотношении: 1г /100г NaCI.
Проведение испытания:
Из фильтрата, полученного при определении нерастворимых в воде веществ (раствор А)
отобрать 50 мл раствора в коническую колбу на 250 мл, прибавить 5 мл 2 н раствора NaOH (едкого натра) и несколько мл смеси мурексида с хлористым натрием (NaСI) до появления красного окрашивания.
Полученный раствор оттитровать 0,05 н раствором трилона «Б» до перехода окраски раствора от красного до фиолетового цвета, при титровании содержимое колбы интенсивно взбалтывать.
Массовую долю кальций-иона (Ca²) в поваренной соли в % вычисляют по формуле:
V4 × k × 0,001002 × 500 × 100
Х5 = mc× V,, (5)
где: V4 – объем раствора трилона «Б», израсходованный на титрование, см³;;
k – коэффициент нормальности для 0,05 н раствора трилона «Б», определяемый по формуле:
где: k = 50/а (где: а – объем 0,05 н р-ра трилона «Б», израсходованный на титрование раствора сернокислого магния (MgSO4), в см³);
500 – общий объем исходного раствора, мл;
mc – масса навески соли в пересчете на сухое вещество, г;
V – объем исходного раствора, взятый для титрования, см³;; (50 мл)
0,001002 – масса кальций-иона, соответствующая 1 мл точно 0,05 н р-ра трилона «Б», г.
3.6. Определение массовой доли магний - иона (Mg²⁺).
Метод основан на способности ионов магния окрашивать комплекс с трилоном «Б» в присутствии кислотного хрома в темно-синий цвет.
Проведение испытания:
50 мл фильтрата, полученного при определении нерастворимых в воде веществ, (из 500 мл) пипеткой перенести в коническую колбу на 250 мл, добавить 5 мл аммиачно-буферного раствора, 5 капель индикатора хром (Cr) темно-синего и титровать 0,5 н р-ром трилона «Б» при интенсивном взбалтывании до перехода окраски от вино - красной до синей.
Массовую долю магния (Mg) в % определяют по формуле:
(V5 – V4) × 0,000608 ×500 × 100
Х6 = mc × V, (6)
где: V5 – объем раствора трилона «Б», израсходованного на титрование Σ Са²⁺ и Mg² - ионов, см³;
V4 – объем раствора трилона «Б», израсходованного на титрование кальций-иона, см³;;
к – коэффициент нормальности для 0,05 н раствора трилона «Б»;
0,000608 – масса магний-иона, соответствующее 1 мл точно 0,05 н раствора трилона «Б», г;
500 – общий объем исходного раствора;
mc – масса навески соли в пересчете на сухое вещество, г;
V – объем раствора, взятый для титрования, см³;.
Пересчет данных анализа, выраженных в %-ном содержании отдельных ионов, на солевой состав производится в порядке, указанном в таблице 3:
Пример:
| Анионы | Катионы | Анионы | Ca | Mg | Na | ||
| Са» | Мg’ | Na’ | SO4² | 1,7% | 1% | ||
| SO4 “ | Ca SO4 | МgSO4 | Na2SO4 | CI | 0,4% | 99,2% | |
| CI ‘ | CaСI2 | Мg СI2 | Na СI | Всего: 102,3% |
| Са² | 0,5% |
| Mg² | 0,3% |
| SO4² | 2 % |
| CI | 60 % |
У 2
0,5 Х Z
1. Ca  + SO
+ SO 
 = CaSO
= CaSO  µ - 40; 96; 136
µ - 40; 96; 136
40 96 136
а) SO 
 в избытке х =
в избытке х =  1,2 г; z =
1,2 г; z =  1,7 г
1,7 г
б) Ca  в избытке
в избытке
у =  0,83 г у = 0,83 > m (Ca
0,83 г у = 0,83 > m (Ca  ) = 0,5 г – предположение неверно
) = 0,5 г – предположение неверно
0,3 у
X 2-1,2 Z
2. Mg  + SO
+ SO 
 = MgSO
= MgSO 
24 96 120
a) Mg  - в избытке
- в избытке
х =  0,2 г, z =
0,2 г, z = 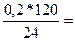 1 г
1 г
б) SO 
 - в избытке
- в избытке
у =  1,2 г; у = 1,2 > 2 – 1,2 (0,8) – предположение неверно
1,2 г; у = 1,2 > 2 – 1,2 (0,8) – предположение неверно
3. Na  + SO
+ SO 
 = Na
= Na  SO
SO  - натрий в избытке
- натрий в избытке
z = 0
x у z
4. Ca  + 2CI
+ 2CI  = CaCI
= CaCI  - хлорид в избытке
- хлорид в избытке
х = 0, т.к. все Ca  связаны с SO
связаны с SO 
 ; у = 0, z = 0.
; у = 0, z = 0.
0,3 – 0,2 x z
5. Mg  + 2CI
+ 2CI  = MgCI
= MgCI  хлорид в избытке
хлорид в избытке
24 2*35,5 95,2
х =  = 0,3 г; z =
= 0,3 г; z =  = 0,4 г.
= 0,4 г.
60-0,3 z
6. Na  + CI
+ CI  = NaCI z =
= NaCI z =  = 99,22
= 99,22
35,5 59
Дата добавления: 2015-07-25; просмотров: 96 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Метод основан на растворении пробы соли в воде, фильтровании полученного раствора, сушке и взвешивании нерастворимого остатка. | | | Исследовать влияние различных антиокислителей на качество жиров при хранении. |