
|
Читайте также: |
Термодинамическую окислительную (или восстановительную) активность соединений в водной среде характеризует потенциал Е0 Его величина опосредованно учитывает тепловые эффекты ( ) всех отдельных стадий процесса. В таблице 3 приведены стадии (и их значения
) всех отдельных стадий процесса. В таблице 3 приведены стадии (и их значения  ) для полуреакции:
) для полуреакции: 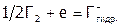 (здесь
(здесь  – гидратированный галид-ион).
– гидратированный галид-ион).
Тепловые эффекты перехода Г2 в гидратированный галид-ион Таблица 3
| Стадия |  , кДж/моль , кДж/моль
| |||
| F | Cl | Br | I | |

| ||||

| –344 | –365 | –338 | –318 |

| –536 | –406 | –386 | –302 |
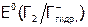 , В , В
| 2.87 | 1.36 | 1.09 | 0.53 |
Подчеркнем, что вещество является тем более сильным окислителем (а значит,величина Е0 тем положительнее), чем слабее химические связи в исходных веществах (в частности, в молекуле Г2), чем больше сродство к электрону элемента, принимающего е и чем прочнее ХС в продуктах (в нашем случае – чем выше теплота гидратации аниона Г–).
Несмотря на то, что фтор имеет меньшее сродство к электрону, чем хлор (табл.3), F2 как окислитель термодинамически значительно сильнее по сравнению с Cl2. Это объясняется меньшей энергией атомизации F2, чем Cl2 и значительно большей (по сравнению с Cl –) теплотой гидратации анионов F – (из-за меньшего их радиуса).
Максимальная (среди Г2) кинетическая активность фтора проявляется также и в водной среде. Например, если F2 сгорает в воде (фиолетовым пламенем):
 ,
,
а значит, реакция идет крайне быстро, то Cl2 (и тем более Br2 и I2) при об.у. реагирует с Н2О спокойно. А поскольку Cl2 (и его аналоги) имеют способность не только окислять, но и (в отличие от фтора) окисляться, то реагируют с водой по типу самоокисления - самовосстановления (дисмутации). При этом один атом, например, хлора отдает электрон, переходя в  (в составе HClO), а другой – забирает е, образуя
(в составе HClO), а другой – забирает е, образуя 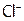 :
:
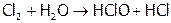 .
.
С точки зрения термодинамики данная реакция не очень обусловлена, ибо для нее К=4,2 10–4, а значит, равновесие процесса сдвинуто влево. Следовательно, основная часть хлора присутствует в его водном растворе (в т.н. хлорной воде) в виде молекул 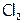 ; и лишь немногие из них (примерно 1 из 14) настолько поляризуются водой, что происходит их дисмутация.
; и лишь немногие из них (примерно 1 из 14) настолько поляризуются водой, что происходит их дисмутация.
В то же время реакция фтора с водой идет необратимо, т.е. ее равновесие полностью сдвинуто вправо.
Подчеркнем, что хлорная вода является сильным окислителем, т.к. присутствующая в ней хлорноватистая кислота 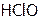 неустойчива, и легко разлагается. При этом образуется HCl и атомарный кислород – очень активный реагент, который (окисляя) может и дезинфицировать, и отбеливать.
неустойчива, и легко разлагается. При этом образуется HCl и атомарный кислород – очень активный реагент, который (окисляя) может и дезинфицировать, и отбеливать.
На практике для этих целей обычно используют соли хлорноватистой кислоты, поскольку они устойчивее, чем сама кислота и, значит, более удобны в обращении. В частности, применяют соль кальция, которую синтезируют по реакции:
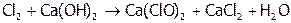 .
.
Продукт (смесь образующихся солей) называется хлорной известью (т.к. получается из извести) или белильной, за то, что отбеливает ткани.. Отбеливание происходит из-за окисления хлорноватистой кислотой, которая, являясь слабым электролитом, образуется при гидролизе Сa(ClO)2.
Отметим, что если Cl2 пропускать через горячую щелочь, то окисление хлора при дисмутации идет до ст.ок. +5, т.е. получаем хлорат калия, т.н. бертоллетову соль (KClO3):
 .
.
Хлорат калия (в отличие от HClO3) устойчив в свободном состоянии (т.е. в виде твердой соли). Однако при нагревании эта соль легко отщепляет атомарный кислород (переходя в KCl). Поэтому  в сухом виде применяют для очень быстрого (взрывного) окисления восстановителей. С этой целью его вводят в состав спичек, пороха, зажигательных смесей (которые используются для фейерверков) и др.
в сухом виде применяют для очень быстрого (взрывного) окисления восстановителей. С этой целью его вводят в состав спичек, пороха, зажигательных смесей (которые используются для фейерверков) и др.
Например, при взрыве пороха, содержащего серу, уголь и бертоллетову соль, идут процессы, которые суммарно отражаются уравнением:
 .
.
Кроме приведенных выше кислородосодержащих веществ хлора (в ст.ок. +1 и +5) можно получить также соединения Cl(III) и Cl(VII).
Дата добавления: 2015-07-25; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Галогены как окислители | | | Общая характеристика. Нахождение в природе. Получение |