
Читайте также:
|
Одна из особенностей водорода состоит в том, что его простое вещество Н2 имеет минимальную молекулярную массу (Мr) и, значит, является самым легким газом (в 14,5 раз легче воздуха, поэтому им наполняют стратостаты, дирижабли и т.п.).
Легкостью водорода объясняется низкое его содержание в атмосфере (всего 10‑4%), хотя на Земле постоянно идут процессы образования Н2. Например, при разложении органических веществ без доступа воздуха. Выделяется он и во время извержения вулканов, при бурении нефтяных скважин (в составе природного газа), а также зелеными листьями растений (при их дыхании).
Однако, почти весь водород улетучивается на высоту примерно 100 км, где атомизируется и ионизируется до 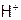 , пополняя т.н. «протонный пояс» Земли. (Именно порывы «протонного ветра» (считают ученые) являются причиной северных сияний, а также нарушений радиосвязи.)
, пополняя т.н. «протонный пояс» Земли. (Именно порывы «протонного ветра» (считают ученые) являются причиной северных сияний, а также нарушений радиосвязи.)
Другой особенностью водорода является то, что энергия связи Н–Н очень велика – составляет 435 кДж/моль. (Самая прочная из всех ординарных ХС.) Это объясняется тем, что в 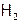 единственные 2 электрона двумя «голыми» ядрами притягиваются особенно сильно, а значит, прочно фиксируются между ними.
единственные 2 электрона двумя «голыми» ядрами притягиваются особенно сильно, а значит, прочно фиксируются между ними.
Как следствие:
а) для реакций с участием Н2 высока энергия активного состояния Еа.с., т.е. процессы идут в достаточно жестких условиях. Например, сероводород (H2S) образуется при пропускании струи водорода над кипящей серой. Таким образом, Н2 не только термодинамически, но и кинетически пассивнее, чем Г2 или ЩМ.
б) из-за большой прочности и, как следствие, жесткости связи Н–Н молекулы водорода (неполярные) обладают незначительной поляризуемостью. А значит, способны лишь к очень слабым дисперсионным взаимодействиям с другими частицами, в том числе, с молекулами растворителей. Поэтому ничтожна растворимость 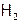 не только в воде, но и в органических жидкостях.
не только в воде, но и в органических жидкостях.
в) особенно слабы дисперсионные взаимодействия молекул водорода между собой. К тому же, частицы 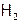 из-за их малой
из-за их малой 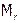 крайне подвижны (наиболее подвижные среди всех молекул). И потому требуется особенно глубокое охлаждение для сжижения[2] водорода. Как следствие (и ничтожной величины дисперсионных взаимодействий, и минимального значения Мr),
крайне подвижны (наиболее подвижные среди всех молекул). И потому требуется особенно глубокое охлаждение для сжижения[2] водорода. Как следствие (и ничтожной величины дисперсионных взаимодействий, и минимального значения Мr), 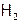 имеет самые низкие (после гелия[3]) температуры кипения (т.кип.) и плавления (т.пл.): –252,2°С и –259,1°С соответственно. Это используется для отделения водорода от других газов (исключая гелий) cнижением температуры, достаточным для вымораживания всех веществ, кроме Н2.
имеет самые низкие (после гелия[3]) температуры кипения (т.кип.) и плавления (т.пл.): –252,2°С и –259,1°С соответственно. Это используется для отделения водорода от других газов (исключая гелий) cнижением температуры, достаточным для вымораживания всех веществ, кроме Н2.
Третья особенность водорода состоит в том, что, в отличие от иных катионов, 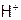 не имеет электронов. Следствием этого является следующее:
не имеет электронов. Следствием этого является следующее:
а) ион Н+, приближаясь к другим атомам, не испытывает межэлектронного отталкивания (ибо нечем отталкиваться от е другого элемента). Поэтому положительно заряженный водород одной молекулы может образовать дополнительную прочную связь с атомом элемента соседней молекулы, если этот атом достаточно отрицательно заряжен. Как, например, F, O или N в соединениях HF, 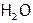 и
и 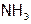 соответственно (а также в органических веществах, содержащих эти элементы). Такие связи между молекулами называются водородными. Они направлены, насыщаемы и значительно прочнее, чем межмолекулярные связи.
соответственно (а также в органических веществах, содержащих эти элементы). Такие связи между молекулами называются водородными. Они направлены, насыщаемы и значительно прочнее, чем межмолекулярные связи.
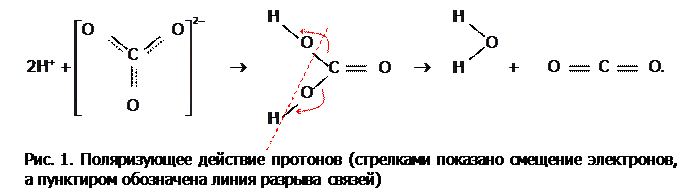
б) являясь «голым» протоном, катион водорода имеет повышенную электрофильность (т.е. любовь к е). Поэтому в соединениях, в частности, в кислородосодержащих кислотах,  в значительной степени перетягивает электроны на себя (что на рисунке 1 отражено стрелками). Это, во-первых, ослабляет связи в анионе, а во-вторых, делает его несимметричным, а потому менее устойчивым. Такое явление называют поляризующим действием катиона на анион или поляризацией.
в значительной степени перетягивает электроны на себя (что на рисунке 1 отражено стрелками). Это, во-первых, ослабляет связи в анионе, а во-вторых, делает его несимметричным, а потому менее устойчивым. Такое явление называют поляризующим действием катиона на анион или поляризацией.
В частности, из-за сильного поляризующего действия Н+ на карбонат-анион угольная кислота настолько нестабильна, что существует только в разбавленных растворах, а при попытке выделить ее в свободном состоянии полностью распадается на оксиды. Механизм распада показан на рис. 1, а в краткой форме этот распад отражается уравнением:
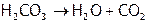 .
.
В то же время карбонат натрия (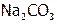 ) даже плавится (при 8580С) без разложения, ибо
) даже плавится (при 8580С) без разложения, ибо 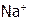 очень слабо поляризует анион из-за низкой ЭО натрия (0,9), гораздо меньшей, чем ЭО водорода (2,1). Другие металлы тоже имеют ЭО ниже, чем Н, и это одна из причин, по которой кислоты менее устойчивы, чем их соли.
очень слабо поляризует анион из-за низкой ЭО натрия (0,9), гораздо меньшей, чем ЭО водорода (2,1). Другие металлы тоже имеют ЭО ниже, чем Н, и это одна из причин, по которой кислоты менее устойчивы, чем их соли.
Дата добавления: 2015-07-25; просмотров: 131 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Сходство со щелочными металлами | | | Получение водорода. Водородная энергетика |