
Читайте также:
|
Устойчивость галогенов в ст.ок. –1 от фтора к иоду снижается (из-за роста r). Поэтому, если 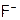 можно окислить лишь электротоком, то
можно окислить лишь электротоком, то 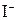 даже бромом:
даже бромом:
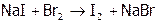 .
.
Но в промышленности для синтеза и I2, и Br2 берут более дешевый реагент – хлор:
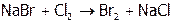 .
.
Хлор в свою очередь получают из хлорида натрия электролизом его расплава, как и 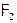 из
из 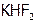 . Однако с гораздо меньшим расходом электроэнергии, поскольку окислить
. Однако с гораздо меньшим расходом электроэнергии, поскольку окислить 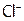 значительно легче, чем
значительно легче, чем 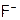 .
.
Кроме того, хлор образуется не только при электролизе расплава, но и раствора соли. В случае же фтора можно использовать лишь расплав, т.к. при электролизе раствора гораздо легче окисляются анионы воды, чем фторид-ионы.
В лаборатории 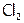 ,
, 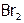 и
и 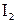 получают тоже из галидов. Однако окислитель берут более удобный в обращении (хотя он может быть не очень дешевым), но главное, чтобы его потенциал
получают тоже из галидов. Однако окислитель берут более удобный в обращении (хотя он может быть не очень дешевым), но главное, чтобы его потенциал 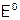 был выше, чем
был выше, чем 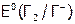 . Чаще используют соединения марганца в сернокислой среде:
. Чаще используют соединения марганца в сернокислой среде:
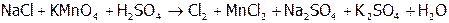 ,
,
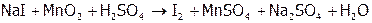 .
.
3.3. Физические свойства Г2
Значения т.пл. и т.кип. простых веществ галогенов закономерно увеличиваются в подгруппе от 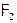 к
к 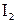 из-за роста и молярной массы вещества, и радиуса атома (последнее приводит к усилению дисперсионных взаимодействий между молекулами
из-за роста и молярной массы вещества, и радиуса атома (последнее приводит к усилению дисперсионных взаимодействий между молекулами 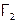 ).
).
Как следствие, если 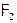 и даже
и даже 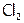 при об.у. – газы (желто-зеленого цвета), то
при об.у. – газы (желто-зеленого цвета), то 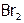 – жидкость (красно-бурая), а иод – уже твердое вещество (темно-фиолетовые кристаллы). Однако I2 имеет молекулярную решетку (как и другие галогены, когда они находятся в твердом состоянии). Такая решетка обеспечивает иоду летучесть (если с вечера оставить его кристаллик на столе, то к утру он “исчезает”), а также способность возгоняться[5].
– жидкость (красно-бурая), а иод – уже твердое вещество (темно-фиолетовые кристаллы). Однако I2 имеет молекулярную решетку (как и другие галогены, когда они находятся в твердом состоянии). Такая решетка обеспечивает иоду летучесть (если с вечера оставить его кристаллик на столе, то к утру он “исчезает”), а также способность возгоняться[5].
При возгонке иод переходит в пары I2 фиолетового цвета; а при их охлаждении снова образуются кристаллы иода. Этот процесс обычно используют для очистки I2 от нелетучих примесей.
Поскольку молекулы галогенов неполярны, то растворимость 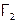 в воде небольшая (например, для хлора – 2,3 л газа в 1 л воды), а в неполярных жидкостях – напротив, хорошая (54,8 л
в воде небольшая (например, для хлора – 2,3 л газа в 1 л воды), а в неполярных жидкостях – напротив, хорошая (54,8 л 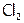 в 1 л тетрахлорида углерода ССl4).
в 1 л тетрахлорида углерода ССl4).
Дата добавления: 2015-07-25; просмотров: 138 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика. Нахождение в природе | | | Галогены как окислители |