
Читайте также:
|
К этим характеристикам относится, прежде всего, заряд ядра (Z), а значит, число электронов в атоме элемента и, следовательно, конфигурация его валентного слоя (орбитали которого и образуют химические связи (ХС)).
Подчеркнем, что валентный слой элемента – это не всегда только внешний. Рассмотрим почему.
В любом атоме электроны стремятся (из-за притяжения ядром) попасть на орбиталь с минимальной энергией, но при условии обязательного выполнения принципа Паули (на одной орбитали – не более двух е).
Энергия же орбитали характеризуется т.н. квантовыми числами, в частности, главным (n), равным номеру периода, в котором находится элемент; а также орбитальным числом (l), характеризующим форму орбитали. Для s-орбитали (сферической формы) значение l равно нулю, для каждой из трех p-орбиталей (гантелевидных) – единице, а для каждой из пяти d-орбиталей (более сложной формы) – двум.
Причем энергия орбитали тем ниже, чем меньше сумма n+l, а при равной сумме – чем меньше значение n (см. табл. 1).
Порядок роста энергии орбиталей Таблица 1
| Орбиталь | 1s | 2s | 2p | 3s | 3p | 4s | 3d | 4p |
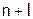
|
Если внимательно ознакомиться с данными таблицы 1, то становится понятным, почему при переходе от Ar к K (а значит, от 3-его периода к 4-ому – см. таблицу Менделеева) заполняется электронами не 3d-, а 4s-орбиталь. А после Ca – не 4р-подуровень, а все пять 3d-орбиталей (от Sc до Zn), т.е. дополняется электронами предвнешний (третий) уровень.
И лишь потом (при переходе к Ga) е заселяют 4р-орбиталь внешнего уровня. Аналогичное наблюдается в 5-ом и 6-ом периодах.
Как следствие указанного порядка заполнения, у всех d-элементов валентными являются орбитали не только внешнего электронного уровня, но и d‑орбитали предвнешнего уровня. Что и требовалось показать.
Подчеркнем, что орбитали могут быть валентными (т.е. способными участвовать в формировании ХС), если их электроны достаточно слабо связаны с ядром. А это е внешнего уровня. Но поскольку предвнешний d-подуровень заполняется после внешней s-орбитали, следовательно электроны на этих d-орбиталях удерживаются ядром примерно так же непрочно, как и внешние s- е. И потому данный d-подуровень является валентным.
К главным характеристикам изолированного атома элемента (кроме Z) относятся также
– атомный радиус r (равный радиусу внешней электронной орбитали,
– энергия ионизации I (которая затрачивается на отрыв от атома его (т.е. «своего») наименее прочно связанного е),
– энергия сродства к электрону F (она выделяется, когда «чужой» е присоединяется к атому),
– электроотрицательность,
– потенциальная валентность.
Электроотрицательность (ЭО) характеризует способность элементов перетягивать на себя т.н. связывающую электронную пару (т.е. осуществляющую ХС данных двух атомов). А поскольку эта пара обычно состоит из «своего» и «чужого» электронов, то значение ЭО (абсолютное) можно рассчитать по формуле: 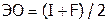 .
.
Чаще пользуются относительными величинами ЭО, т.е. шкалой Полинга, в которой ЭО лития принята за 1, а ЭО(F)=4.
Как правило, чем больше Z атома Э и меньше его r, тем выше (в соответствии с законом Кулона) значения I, F и, следовательно, ЭО данного элемента.
Потенциальная валентность (ПВ) атома Э отражает его максимальную способность формировать ХС. Численно ПВ равна количеству всех валентных орбиталей. Так, потенциальная валентность водорода, имеющего одну валентную орбиталь, равна единице (записывается ПВ(Н)=1), т.е. водород одновалентен. Для любого из элементов 2-го периода ПВ=4, т.е. они четырехвалентны, ибо для образования ХС могут использовать одну s- и три р-орбитали. А для 3-го периода ПВ(Э)=9, т.к. у них кроме s- и p- есть еще пять d-орбиталей на валентном уровне. И т.д.
Дата добавления: 2015-07-25; просмотров: 225 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Периодическая система | | | Характеристики элементов в составе соединений |