
|
Читайте также: |
В периодической таблице значения ЭО s- и p-элементов растут как слева направо в периодах (т.е. от ЩМ к Г), так и снизу вверх в подгруппах (в случае галогенов от I к F). Вследствие чего, в этих же направлениях, как правило, усиливается термодинамическая окислительная активность их простых веществ; поэтому 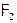 – самый сильный окислитель (
– самый сильный окислитель (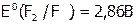 ). Он не реагирует лишь с первыми тремя (в таблице Менделеева) благородными газами.
). Он не реагирует лишь с первыми тремя (в таблице Менделеева) благородными газами.
Хлор же не окисляет все БГ, а также 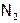 ,
, 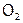 и уголь. Хотя косвенным путем (т.е. с помощью других химических реакций) синтезированы его соединения с N, O и C. В частности, получены оксиды хлора во всех нечетных ст.ок.: от +1 до +7.
и уголь. Хотя косвенным путем (т.е. с помощью других химических реакций) синтезированы его соединения с N, O и C. В частности, получены оксиды хлора во всех нечетных ст.ок.: от +1 до +7.
Бром, в отличие от хлора, не действует на платину, но с золотом дает бромид 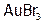 . (Поэтому нельзя работать с Br2 в золотых украшениях.)
. (Поэтому нельзя работать с Br2 в золотых украшениях.)
Иод – наиболее пассивный реагент среди 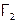 , но окисляет при об.у. серу, фосфор, достаточно активные М (алюминий, железо). Однако, если, например, Al при взаимодействии с Br2 раскаляется добела, то при реакции с I2 – лишь докрасна.
, но окисляет при об.у. серу, фосфор, достаточно активные М (алюминий, железо). Однако, если, например, Al при взаимодействии с Br2 раскаляется добела, то при реакции с I2 – лишь докрасна.
Разная окислительная способность Г2 определяет различные области их применения. Так, 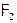 используют как эффективный окислитель ракетного топлива,
используют как эффективный окислитель ракетного топлива, 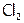 – для дезинфекции воды,
– для дезинфекции воды, 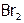 – в органическом синтезе, а
– в органическом синтезе, а 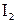 (в виде аптечного иода[6]) – как антисептическое средство для заживления кожных ран.
(в виде аптечного иода[6]) – как антисептическое средство для заживления кожных ран.
3.4.2. Взаимодействие Г2 с водородом. Получение HCl и ее свойства. Галогеноводородные кислоты
Водород и термодинамически, и кинетически достаточно пассивное вещество, поэтому в реакциях с ним особенно явно видно различие в химическом поведении соединений, в частности, галогенов. Так, иод (с позиции термодинамики наиболее слабый окислитель среди 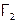 ) реагирует с водородом обратимо (К=54,4 при 4250С), в то время как другие галогены – практически необратимо. Снизу вверх в подгруппе растет и кинетическая активность
) реагирует с водородом обратимо (К=54,4 при 4250С), в то время как другие галогены – практически необратимо. Снизу вверх в подгруппе растет и кинетическая активность 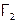 . Например, бром взаимодействует с
. Например, бром взаимодействует с 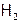 выше 3000С, хлор – на свету при об.у., а фтор – со взрывом даже в темноте. (Продукт HF часто записывают формулой
выше 3000С, хлор – на свету при об.у., а фтор – со взрывом даже в темноте. (Продукт HF часто записывают формулой 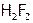 .)
.)
Рассмотрим подробнее реакцию водорода с хлором, имеющую промышленное значение. При обычных условиях в смеси 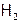 и
и 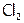 процесс практически не идет. Однако при солнечном облучении происходит взрыв, т.к. под действием световой энергии молекулы хлора распадаются на атомы. А это очень активные частицы, как следствие, резко (до взрыва) возрастает скорость реакции. Однако если струю
процесс практически не идет. Однако при солнечном облучении происходит взрыв, т.к. под действием световой энергии молекулы хлора распадаются на атомы. А это очень активные частицы, как следствие, резко (до взрыва) возрастает скорость реакции. Однако если струю 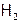 направить в атмосферу CI2 и сразу же поджечь, то идет спокойное горение (зеленым пламенем). Так получают хлорид водорода в промышленности.
направить в атмосферу CI2 и сразу же поджечь, то идет спокойное горение (зеленым пламенем). Так получают хлорид водорода в промышленности.
Кипит он при – 850С, т.е. (несмотря на бóльшую молекулярную массу) ниже, чем HF (+190С). Причина – менее сильные связи между молекулами 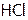 . А далее в подгруппе от HCl к НI значения т.кип. растут.
. А далее в подгруппе от HCl к НI значения т.кип. растут.
Хлорид водорода (как и другие HГ), благодаря полярности молекул, хорошо растворим в воде: 507 л в 1 л воды (при 00С), что соответствует массовой доле 45%. Растворы НГ в воде называются галогеноводородными [7] кислотами.
Сила кислот от HF к HI увеличивается, вследствие роста радиуса галогена. Так, 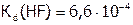 , а
, а 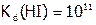 .
.
Хлороводородная кислота является сильной (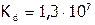 ). Она вступает во все реакции, характерные для данного класса веществ. А именно: HCl взаимодействует с М[8], стоящими в ряду напряжений левее, с оксидами металлов, со щелочами и малорастворимыми гидроксидами:
). Она вступает во все реакции, характерные для данного класса веществ. А именно: HCl взаимодействует с М[8], стоящими в ряду напряжений левее, с оксидами металлов, со щелочами и малорастворимыми гидроксидами:
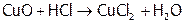 ,
,
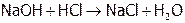 ,
,
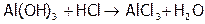 .
.
А также с солями, если при этом образуется слабая кислота или осадок хлорида М:
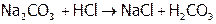 ,
,
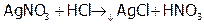 .
.
Подчеркнем, что с помощью AgNO3 можно проводить качественные реакции [9] на галид-ионы, с целью различить их между собой. А именно: AgF хорошо растворим, 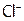 дает с
дает с 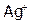 белый осадок,
белый осадок, 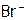 – желтоватый, a
– желтоватый, a 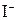 – желтый. С другой стороны, ионы
– желтый. С другой стороны, ионы 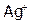 обнаруживают в растворе, добавляя, например, NaCl.
обнаруживают в растворе, добавляя, например, NaCl.
Отметим, что хлороводородная кислота входит в состав желудочного сока, т.е. участвует в переваривании пищи, поэтому ее используют в медицине (принимают при пониженной кислотности желудка), а также в пищевой промышленности.
Дата добавления: 2015-07-25; просмотров: 163 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Получение простых веществ. | | | Окислительно-восстановительные реакции в водных растворах. Кислородосодержащие соединения хлора |