
|
Читайте также: |
К халькогенам (Х) относятся p-элементы VI группы таблицы Менделеева: кислород, сера (ее название означает «светло-желтая») и их аналоги. Электронная конфигурация валентного слоя атомов Х: s2p4.
Следовательно, до устойчивой конфигурации не хватает двух е. И присоединяя их, Х проявляют ст.ок. –2. Кислород и даже сера в этой ст.ок. настолько устойчивы, что именно в ней чаще всего находятся в природе. А т.к. их кларки высоки: 58% для кислорода[10] (1-ое место по распространенности) и 0,03% для серы (больше, чем для любого из галогенов), то они образуют подавляющее большинство соединений на Земле.
Это оксиды (например, железные руды: 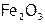 ,
, 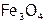 и др.), кислородосодержащие соли: карбонаты (мел, известняк, малахит и т.д.), силикаты (являющиеся основой всех горных пород) и т.п. Кроме того, сульфиды [11]: железный колчедан или пирит[12] (
и др.), кислородосодержащие соли: карбонаты (мел, известняк, малахит и т.д.), силикаты (являющиеся основой всех горных пород) и т.п. Кроме того, сульфиды [11]: железный колчедан или пирит[12] ( ), цинковая обманка (ZnS), киноварь (HgS) и др. А также сульфаты: глауберова соль (
), цинковая обманка (ZnS), киноварь (HgS) и др. А также сульфаты: глауберова соль (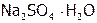 ), горькая соль (
), горькая соль ( ), гипс (
), гипс (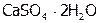 ) и т.п. Вот почему элемент данной группы названы халькогенами, что значит, рудообразующие.
) и т.п. Вот почему элемент данной группы названы халькогенами, что значит, рудообразующие.
Поскольку 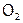 и S менее активны, чем Г2, то встречаются в природе и в виде простых веществ. Так,
и S менее активны, чем Г2, то встречаются в природе и в виде простых веществ. Так, 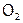 входит в состав атмосферы (21% объема воздуха, что составляет 1015 т, но это лишь 1/10 000 всего кислорода на Земле). Самородная же сера встречается, например, вблизи вулканов как продукт взаимодействия вулканических газов: сернистого
входит в состав атмосферы (21% объема воздуха, что составляет 1015 т, но это лишь 1/10 000 всего кислорода на Земле). Самородная же сера встречается, например, вблизи вулканов как продукт взаимодействия вулканических газов: сернистого  и сероводорода H2S.
и сероводорода H2S.
В промышленности серу получают из самородной, отделяя ее от примесей переплавкой. А О2 выделяют из воздуха ректификацией. Этот процесс заключается в том, что воздух (очищенный от пыли, влаги и углекислого газа) сжижают, охлаждая до -200°С; после чего постепенно нагревают. И поскольку т.кип. азота (-196°С) ниже, чем кислорода (-183°С), то N2 выкипает первым. (То есть данным способом одновременно получают и азот.) В ходе ректификации цвет жидкости меняется от слегка голубоватого до явно голубого.
В лаборатории серу используют реактивную (готовое товарное вещество), а кислород берут из баллонов (голубого цвета), где он находится под давлением 100‑150 атм. Небольшие его количества получают, например, нагревая перманганат калия (при этом образуются также манганат калия и диоксид марганца):
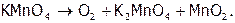
Дата добавления: 2015-07-25; просмотров: 74 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Окислительно-восстановительные реакции в водных растворах. Кислородосодержащие соединения хлора | | | Структура и физические свойства простых веществ |