
Читайте также:
|
(1)Роднит водород с Г (и одновременно резко отличает его от ЩМ) сравнительно высокая электроотрицательность Н. (Сравним, у лития ЭО равна 1, в то время как у водорода – 2,1, а у иода – 2,5.) В результате чего атомы Н друг с другом образуют не металлическую связь, как ЩМ, а ковалентную. А т.к. она направлена и насыщаема, то при одном неспаренном электроне могут сформироваться лишь двухатомные молекулы 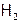 , как и в случае галогенов (
, как и в случае галогенов (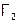 ).
).
(2) И водород, и галогены, стремясь завершить валентные уровни своих атомов, проявляют окислительные свойства. Однако Н из-за малого Z ядра имеет меньшее сродство к электрону, чем даже иод. Поэтому 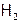 как окислитель слабее, чем
как окислитель слабее, чем 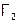 . (Сравним:
. (Сравним: 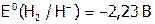 , а даже у иода
, а даже у иода 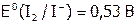 .) Как следствие, водород реагирует лишь с достаточно сильными восстановителями; такими, как, например, ЩМ и щелочно-земельные металлы (ЩЗМ):
.) Как следствие, водород реагирует лишь с достаточно сильными восстановителями; такими, как, например, ЩМ и щелочно-земельные металлы (ЩЗМ):
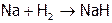 ,
,
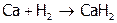 .
.
(3) Продукты данных реакций (они называются гидридами) – твердые вещества, имеющие ионную решетку, как и галиды (в частности, хлориды NaCl или 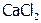 ). Но гидриды (в отличие от галидов) очень сильные восстановители. Поскольку Н– слишком слабо удерживает электрон (из-за сравнительно малого сродства к нему атома водорода). Вследствие этого гидриды (но не галиды) при обычных условиях окисляются даже водородом воды:
). Но гидриды (в отличие от галидов) очень сильные восстановители. Поскольку Н– слишком слабо удерживает электрон (из-за сравнительно малого сродства к нему атома водорода). Вследствие этого гидриды (но не галиды) при обычных условиях окисляются даже водородом воды:
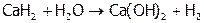 .
.
Эту реакцию используют для получения 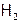 (например, в полевых условиях). А также для осушки газов (т.е. очистки их от влаги), для чего газы пропускают через трубку с гранулами (мелкими кусочками) гидрида кальция.
(например, в полевых условиях). А также для осушки газов (т.е. очистки их от влаги), для чего газы пропускают через трубку с гранулами (мелкими кусочками) гидрида кальция.
Дата добавления: 2015-07-25; просмотров: 165 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Характеристики элементов в составе соединений | | | Сходство со щелочными металлами |