
Читайте также:
|
(1) Водород и щелочные металлы имеют одинаковые конфигурации внешнего электронного уровня (s1) и, как следствие, похожие оптические спектры.
(2) Со ЩМ водород объединяет способность отдавать электроны и, значит, восстанавливать другие элементы. Однако, из-за малого радиуса атома Н (и, как следствие, высокой энергии его ионизации) 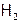 как восстановитель гораздо слабее, чем ЩМ (сравним:
как восстановитель гораздо слабее, чем ЩМ (сравним: 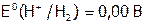 , a, например, Е0 (Na+/ Na)= –2,71 В).
, a, например, Е0 (Na+/ Na)= –2,71 В).
Поэтому реагируют с 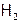 лишь достаточно сильные окислители (из простых веществ это Г2, О2, N2 и S).
лишь достаточно сильные окислители (из простых веществ это Г2, О2, N2 и S).
Имея дело с водородом на практике, следует помнить, что смесь его с О2, содержащая от 7 до 67% (об.) 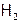 , взрывоопасна (причем взрыв может произойти от искры или при контакте с нагретым предметом). В то же время струя чистого водорода спокойно горит в кислороде. (Продукт и взрыва, и горения одинаков – вода.)
, взрывоопасна (причем взрыв может произойти от искры или при контакте с нагретым предметом). В то же время струя чистого водорода спокойно горит в кислороде. (Продукт и взрыва, и горения одинаков – вода.)
При горении скорость реакции сравнительно небольшая и определяется быстротой смешивания 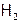 и
и 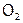 на поверхности водородной струи. А в смеси
на поверхности водородной струи. А в смеси 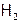 и
и 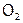 молекулы уже максимально перемешаны, поэтому скорость процесса многократно выше.
молекулы уже максимально перемешаны, поэтому скорость процесса многократно выше.
Отметим, что реакции синтеза хлороводорода и аммиака:
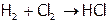 ,
,

имеют промышленное значение.
Благодаря восстановительным свойствам, водород (как и ЩМ) вытесняет металлы из их оксидов. Это используется в металлургии, например, при получении железа (из руды):

(3) Сходство водорода и ЩМ проявляется также в том, что в водном растворе продукты их окисления присутствуют в виде однозарядных гидратированных катионов (в отличие от галогенов).
Дата добавления: 2015-07-25; просмотров: 57 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Сходство с галогенами | | | Особенности водорода |