
Читайте также:
|
ПС VIIА
галогены – типичные неметаллы,
строение внешней е-оболочки..s2р5, р-элементы
2s 2p
 |  |  |  |
1s
 |
F



 + 9 3s 3p 3d
+ 9 3s 3p 3d
2s 2p




1s

Cl
+17
особенность е- строения галогенов -внешний эн.уровень практически заполнен e-,
атомы галогенов проявляют высокую электроотрицательность,
галогены – окислители, в соединениях с фтором и кислородом - восстановители,
при возбуждении е- распариваются и переходят от s-и р-орбиталей на свободные d-орбитали,
элементы главных подгрупп проявляют сходную степень окисления
(физ.смысл) окисление – процесс отдачи е-, степень окисления - количество отданных е-,
элементы главных подгрупп отдают “s”-“р”e- внешнего эн.уровня,
имея общую структуру валентных е-, они проявляют сходную степень окисления,
ст.окисления и валентность фтор 0 –1 (I)
хлор 0 –1 +1 +3 +5 +7 (I III V VII)
бром 0 –1 +1 +3 +5 +7
иод 0 –1 +1 +3 +5 +7
галогены имеют нечетные ст.окисления из-за нечетного числа валентных(неспаренных) е-:
атомы галогенов в невозбужденном состоянии имеют 1 неспаренный е-(нечетное число),
при возбуждении и распаривании е- число неспаренных е- увеличивается на 2-4-6,
в результате число неспаренных е- остается нечетным,
номер группы, как правило, равен max(+)степени окисления хим.элементов данной группы
ПР: VIIА max(+)степень окисления +7 (кроме F 0)
сравнение физ. и хим.свойств галогенов
| Tкип°C | Tплав°C | |||||
| F | неметаллы | F2 -188 | газ | желтый | ||
| Cl | Cl2 -34 | газ | жёлто-зелёный | резкий запах | ||
| Br | Br2 59 | жидкость | красно-бурая | |||
| I | I2 113 | тв. | серо-фиолетовое | возгонка | ||
| At |
3. галогены – типичные неметаллы, имеют похожие свойства и отличные свойства
окислители
реакции с металлами
 *Cl2 + 2Na 2NaCl галогениды
*Cl2 + 2Na 2NaCl галогениды
 3Cl2 + 2Fe T 2FeCl3
3Cl2 + 2Fe T 2FeCl3
2Al + 3F2 ® 2AlF3 самовоспламенение
2Al + 3Cl2 T ® 2AlCl3
2Al + 3Br2 T ® 2AlBr3
2Al + 3I2 T ® Н2О 2AlI3
реакции с водородом и другими неметаллами..
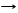 *F2 + H2 2HF цепная реакция cо взрывом
*F2 + H2 2HF цепная реакция cо взрывом
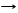 Cl2 + H2 hn 2HCl цепная реакция до взрыва(радикальный механизм реакции)
Cl2 + H2 hn 2HCl цепная реакция до взрыва(радикальный механизм реакции)
Br2 + H2 ® 2HBr
I2 + H2 T Û 2HI
 *2P + 3Cl2 2PCl3
*2P + 3Cl2 2PCl3
 2P + 5Br2 2PBr5
2P + 5Br2 2PBr5
 *H2S + Сl2 S + 2HCl
*H2S + Сl2 S + 2HCl
 H2S + Br2 S + 2HBr
H2S + Br2 S + 2HBr
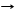 H2S + I2 S + 2HI
H2S + I2 S + 2HI
 *H2SO3 + Cl2 + H2O H2SO4 + 2HCl
*H2SO3 + Cl2 + H2O H2SO4 + 2HCl
 H2SO3 + Br2 + H2O H2SO4 + 2HBr
H2SO3 + Br2 + H2O H2SO4 + 2HBr
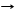 H2SO3 + I2 + H2O H2SO4 + 2HI
H2SO3 + I2 + H2O H2SO4 + 2HI
реакции диспропорционирования, где галогены окислители и восстановители
*реакция с водой хлора-брома, фтор окисляет H2O
8F2 + 8H2O ® 14HF + OF2 + O2 + H2O2 + O3
 Cl2 + H2O Û HCl + HClO затем HClO HCl + O
Cl2 + H2O Û HCl + HClO затем HClO HCl + O
Br2 + H2O Û Hbr + HBrO
*реакции с щелочами (кроме F2)
 2NaOH + Cl2 холод NaCl + NaClO + H2O
2NaOH + Cl2 холод NaCl + NaClO + H2O
 2NaOH + Br2 NaBr + NaBrO + H2O
2NaOH + Br2 NaBr + NaBrO + H2O
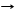 6NaOH + 3Cl2 T 5NaCl + NaClO3 + 3H2O
6NaOH + 3Cl2 T 5NaCl + NaClO3 + 3H2O
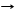 6KOH + 3Cl2 T 5KCl + 3H2O + KClO3 бертолетова соль
6KOH + 3Cl2 T 5KCl + 3H2O + KClO3 бертолетова соль
 Ca(OH)2 + Cl2 H2O + CaClOCl
Ca(OH)2 + Cl2 H2O + CaClOCl
иод не реагирует с большинством металлов, водой, плохо реагирует с водородом
2Al + 3I2 T ® Н2О 2AlI3
I2 + H2 T Û 2HI
бром более активен чем иод, но менее активен, чем хлор,
хлор - сильный окислитель (не реагирует только с С O2 N2 инертными газами)
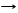 Cl2 + H2 hn 2HCl цепная реакция до взрыва(радикальный механизм реакции)
Cl2 + H2 hn 2HCl цепная реакция до взрыва(радикальный механизм реакции)
*реакция хлора с водой
 Cl2 + H2O Û HCl + HClO затем HClO HCl + O
Cl2 + H2O Û HCl + HClO затем HClO HCl + O
сильнейший окислитель F2(не реагирует только с He-Ne-Ar)
2Al + 3F2 ® 2AlF3 самовоспламенение
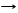 F2 + H2 2HF цепная реакция cо взрывом
F2 + H2 2HF цепная реакция cо взрывом
фтор окисляет Cl2 и другие галогены
 Cl2 + F2 2ClF
Cl2 + F2 2ClF
фтор окисляет Xe
 Xe + F2 hn XeF2
Xe + F2 hn XeF2
фтор окисляет H2O
 H2O + F2 HF + O O + F2 ® OF2 O + H2O ® H2O2 O + O2 ® O3
H2O + F2 HF + O O + F2 ® OF2 O + H2O ® H2O2 O + O2 ® O3
8F2 + 8H2O ® 14HF + OF2 + O2 + H2O2 + O3
*реакции замещения(более активный галоген вытесняет менее активный)
 2KI + Br2 I2 + 2KBr
2KI + Br2 I2 + 2KBr
 2HI + Br2 I2 + 2HBr
2HI + Br2 I2 + 2HBr
 2KI + Cl2 I2 + 2KCl
2KI + Cl2 I2 + 2KCl
 2HI + Сl2 I2 + 2HCl
2HI + Сl2 I2 + 2HCl
с ростом величины порядкового номера в главной подгруппе неметаллические свойства ¯
(физ.смысл) при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «F – I»
с ростом величины порядкового номера в главной подгруппе окислительные свойства ¯
(физ.смысл) размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «F - I»
сравнение физ. и хим.свойств водородных соединений галогенов
| HR | Tкип°C | |||
| НF | газы | растворы–кислоты | восстановители | |
| НCl | -85 | |||
| НBr | -67 | |||
| НI | -35 | |||
высокая Tкип фтороводорода определяется водородными связями между молекулами фтороводорода (НF)2
3. НF НCl НBr НI- летучие соединения с полярной ковалентной хим.связью,
водородные соединения галогенов имеют похожие свойства и отличные свойства
восстановители
 *4HCl + MnO2 Т MnCl2 + Cl2 + 2H2O
*4HCl + MnO2 Т MnCl2 + Cl2 + 2H2O
 16HCl + 2KMnO4 5Cl2 + 2KCl + 2MnCl2 + 8H2O
16HCl + 2KMnO4 5Cl2 + 2KCl + 2MnCl2 + 8H2O
 6HCl + KСlO3 KCl + 3H2O + 3Cl2
6HCl + KСlO3 KCl + 3H2O + 3Cl2
2H2SO4 конц + 2KBr ® Br2 + SO2 + K2SO4 + 2H2O
5H2SO4 конц + 8KI ® 4I2 + H2S + 4K2SO4 + 4H2O
водные растворы НF НCl НBr НI– кислоты
*электролитическая диссоциация
HF Û H+ + F-
HCl ® H+ + Cl-
HBr ® H+ + Br-
HI ® H+ + I-
*реакции замещения
2HCl + Mg ® MgCl2 + H2
реакции обмена(условия необратимости реакции..)
*2HCl + CaO ® H2O + CaCl2
*HCl + NaOH ® NaCl + H2O реакция нейтрализации эквивалентных количеств H+ и OH-
HBr + NaOH ® NaBr + H2O
HI + NaOH ® NaI + H2O
*ZnS + 2HCl ® ZnCl2 + H2S
AgNO3 + HCl ® AgCl¯ + HNO3
 Ag+ + Cl- AgCl¯белый
Ag+ + Cl- AgCl¯белый
AgNO3 + HBr ® AgBr¯ + HNO3
AgNO3 + HI ® AgI¯ + HNO3
*соединения HBr и HI непрочные
2HBr ® H2 + Br2
2HI ® H2 + I2
*реакции замещения(более активный галоген вытесняет менее активный)
 2KI + Br2 I2 + 2KBr
2KI + Br2 I2 + 2KBr
 2HI + Br2 I2 + 2HBr
2HI + Br2 I2 + 2HBr
 2KI + Cl2 I2 + 2KCl
2KI + Cl2 I2 + 2KCl
 2HI + Сl2 I2 + 2HCl
2HI + Сl2 I2 + 2HCl
*водные растворы НCl НBr НI– сильные кислоты(сильные электролиты),
плавиковая кислота НF слабая кислота(слабый электролит)
 особенность плавиковой кислоты SiO2 + 4HF SiF4 + 2H2O травление стекла, очистка литья от песка
особенность плавиковой кислоты SiO2 + 4HF SiF4 + 2H2O травление стекла, очистка литья от песка
с ростом порядкового номера в главной подгруппе прочность водородных соединений ¯
(физ.смысл) размеры атомов , слабеет их связь с атомами водорода
с ростом порядкового номера в главной подгруппе кислотные свойства водородных соединений
(физ.смысл) размеры атомов , прочность водородных соединений уменьшается,
усиливается эл.диссоциация Н(неМе)®Н+ + неМе-
с ростом порядкового номера в главной подгруппе восстановительные свойства водородных соединений
(физ.смысл) размеры атомов , прочность водородных соединений уменьшается,
размеры атомов , слабеет связь валентных е- с ядром атома,
в итоге, при разрушении водородные соединения легче отдают электроны
 |  |
Н+ Н+
 |  | ||
неМе-
неМе- 
 |
применение галогенов и их соединений
4. хлор Cl2 дезинфекцирующее-отбеливающее средство(действует в присутствии воды)
H2O + Cl2 Û HСl + HClО хлорноватистая к-та - сильный окислитель НСlO ® НСl + О
отбеливание тканей-бумаги, дезинфекция питьевой воды
!отравления(реакция с водой на слизистых и повреждение слизистых легких и дыхательных путей до удушья)
хлорная известь CaOCl2 дезинфекцирующее-отбеливающее средство(действует в присутствии воды)
2 Са(ОН)2 + 2Cl2 ® Ca(ОCl)2 + CaCl2 + 2H2O
Ca(OH)2 + Cl2 ® H2O + Ca(ОCl)Cl хлорная известь
в реакции с водой образует хлорноватисую кислоту - сильный окислитель
Ca(ClO)2 + Н2О + СО2 ® СаСО3¯ + 2НСlO хлорноватистая к-та НСlO ® НСl + О
бертолетова соль KClO3 компонент пороха-взрывчатых в-в-спичек,
разлагается с выделением кислорода
 2KClO3 Т МnO2 2KCl + 3O2
2KClO3 Т МnO2 2KCl + 3O2
соляная кислота HCl очищает Me от окислов при пайке, которые легко удаляются с поверхности металла
2HCl + CuO ® H2O + CuCl2
хлороводород HCl используется в органической химии в реакциях с алкенами-алкинами..
HCl + CHºC-CН=CH2 ® CH2=CCl-CH=CH2 хлоропрен
KCl калийное удобрение
–(CF2-CF2)n- тефлон прочный-негорючий материал
CCl2-F2 фреон в холодильниках
CH2=CНCl хлорвинил е-изолятор и пластмассовые изделия
CH2=CCl-CH=CH2 хлоропрен для прочных каучуков
 в фотографии используется реакция AgBr hn Br2 + 2Ag¯ серебро образует негативное изображение
в фотографии используется реакция AgBr hn Br2 + 2Ag¯ серебро образует негативное изображение
соединения брома лекарство
йод I2 дезинфицирующее средство!ожоги
хлор, положение хлора в периодической системе
электронное строение атома, степени окисления, валентность
хлор 3s 3p 3d
2s 2p







1s

Cl
+17
ПС №17 3период VIIА
строение е-оболочек +17Сl 1s22s2р63s2р5d0, р-элемент,
при возбуждении е- распариваются и переходят от s-р-орбитали на свободные d-орбитали,
возможна гибридизация,
хлор – окислитель, в соединениях с фтором и кислородом – восстановитель,
Cl 0 + e- ® Cl -
Сl 0 - e- ® Cl +
Сl 0 - 3e- ® Cl +3
Сl 0 - 5e- ® Cl +5
Сl 0 - 7e- ® Cl +7
ст.окисления и валентность 0 –1 +1 +3 +5 +7 (I III V VII)
ПР: Cl2 HCl HClO хлорноватистая
HClO2 хлористая
HClO3 хлорноватая
HClO4 хлорная
в природе хлор встречается в виде хим.соединений(ст.окисления –1)
ПР: NaCl каменная соль
NaCl*KCl сильвинит
получение хлора
ХЛОР Cl2
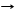 1.2. 16HCl + 2KMnO4 5Cl2 + 2KCl + 2MnCl2 + 8H2O
1.2. 16HCl + 2KMnO4 5Cl2 + 2KCl + 2MnCl2 + 8H2O
 4HCl + MnO2 Т MnCl2 + Cl2 + 2H2O
4HCl + MnO2 Т MnCl2 + Cl2 + 2H2O
 6HCl + KСlO3 KCl + 3H2O + 3Cl2
6HCl + KСlO3 KCl + 3H2O + 3Cl2
 14HCl + K2Cr2O7 2KCl + 2CrCl3 + 7H2O + 3Cl2
14HCl + K2Cr2O7 2KCl + 2CrCl3 + 7H2O + 3Cl2
 2NaCl + 2H2O электролиз 2NaOH + Cl2 + H2
2NaCl + 2H2O электролиз 2NaOH + Cl2 + H2
физ.свойства хлора
2.(н.у.)газ желто-зеленый-с резким удушливым запахом(ядовит)-тяжелее воздуха,¯растворим H2O, Tкип Cl2=-34°C
применение хлора
4. хлор Cl2 дезинфекцирующее-отбеливающее средство(действует при присутствии воды)
H2O + Cl2 Û HСl + HClО хлорноватистая к-та - сильный окислитель НСlO ® НСl + О
отбеливание тканей-бумаги, дезинфекция питьевой воды
!отравления(реакция с водой на слизистых и повреждение слизистых легких и дыхательных путей до удушья)
получение соляной кислоты HCl, хлорной извести CaOCl2
хим.свойства хлора
взаимодействие хлора с органическими и неорганическими веществами
окислительные свойства водного раствора хлора
3. неметалл
окислитель хлор не реагирует с С O2 N2 инертными газами
 *Cl2 + 2Na 2NaCl
*Cl2 + 2Na 2NaCl
 3Cl2 + 2Fe T 2FeCl3
3Cl2 + 2Fe T 2FeCl3
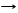 *Cl2 + H2 hn 2HCl цепная реакция до взрыва(радикальный механизм реакции)
*Cl2 + H2 hn 2HCl цепная реакция до взрыва(радикальный механизм реакции)
 2P + 3Cl2 2PCl3
2P + 3Cl2 2PCl3
 *H2S + Сl2 S + 2HCl
*H2S + Сl2 S + 2HCl
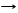 *Cl2 + H2O Û HCl + HClO затем HClO HCl + O дезинфекция-отбеливание
*Cl2 + H2O Û HCl + HClO затем HClO HCl + O дезинфекция-отбеливание
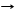 *HgO + 2Cl2 HgCl2 + Cl2O
*HgO + 2Cl2 HgCl2 + Cl2O
 *H2SO3 + Cl2 + H2O H2SO4 + 2HCl
*H2SO3 + Cl2 + H2O H2SO4 + 2HCl
*HCOOH + Cl2 ® CO2 + 2HCl
*реакции замещения
 2KI + Cl2 I2 + 2KCl более активный галоген вытесняет менее активный, качественная реакция
2KI + Cl2 I2 + 2KCl более активный галоген вытесняет менее активный, качественная реакция
 2HI + Сl2 I2 + 2HCl
2HI + Сl2 I2 + 2HCl
*реакции диспропорционирования, где хлор окислитель и восстановитель
 Cl2 + H2O Û HCl + HClO затем HClO HCl + O дезинфекция-отбеливание
Cl2 + H2O Û HCl + HClO затем HClO HCl + O дезинфекция-отбеливание
 HgO + 2Cl2 HgCl2 + Cl2O
HgO + 2Cl2 HgCl2 + Cl2O
 *2NaOH + Cl2 холод NaCl + NaClO + H2O
*2NaOH + Cl2 холод NaCl + NaClO + H2O
 6NaOH + 3Cl2 T 5NaCl + NaClO3 + 3H2O
6NaOH + 3Cl2 T 5NaCl + NaClO3 + 3H2O
 6KOH + 3Cl2 T 5KCl + 3H2O + KClO3 бертолетова соль
6KOH + 3Cl2 T 5KCl + 3H2O + KClO3 бертолетова соль
 Ca(OH)2 + Cl2 H2O + CaClOCl получение хлорной извести
Ca(OH)2 + Cl2 H2O + CaClOCl получение хлорной извести
*реакции замещения с алканами
СН4 + Cl2 Т ® hn СH3-Cl + HCl хлорметан
реакции присоединения с алкенами
СН2=СН2 + Cl2 ® CH2Cl-CH2Cl дихлорэтан
реакции замещения с бензолом-толуолом-фенолом
Cl
|
 | |||
 | |||


+ Cl2® AlCl3 + НCl
хлорбензол
СН3 СН3
| |


-Cl
+ Cl2® AlCl3 + НCl
OH OH

 | |
| |
 Cl- -Cl
Cl- -Cl 
+ 3Cl2 ® + 3НCl
| 2,4,6-трихлорфенол
Cl
реакции замещения в боковой цепи
CH3 CH2Cl

 | |
| |
 |  |
+ Cl2 hn ® + HCl
реакции присоединения с бензолом
Cl
|
 | |||
 | |||
 Cl- -Cl
Cl- -Cl
+ 3Cl2 ® hn УЛФ
Cl- -Cl
|
Cl гексахлорциклогексан
реакции замещения с альдегидами
CH3-СОН + 3Сl2 ® Cl3С-СOH + 3HCl хлораль (активно окисляется)
реакции замещения с органическими кислотами
CH3-СООН + Cl2 ® Cl-СН2-COOH + HCl хлоруксусная к-та
хлороводород, способы получения, горение хлора в водороде
ХЛОРОВОДОРОД HCl
1.2. 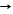 *H2 + Cl2 hn 2HCl цепная реакция(радикальный механизм реакции)
*H2 + Cl2 hn 2HCl цепная реакция(радикальный механизм реакции)
- инициирование цепи Cl2 Т ® hn 2Cl·
- рост цепи Cl· + Н2® HCl + Н·
Н· + Cl2® НCl + Cl·
- обрыв цепи Н· + Cl·® НCl 2Н· ® Н2 2Cl·® Cl2
*реакции обмена между солями и другими кислотами(условия необратимости реакции..)

 H2SO3 + Cl2 + H2O H2SO4 + 2HCl
H2SO3 + Cl2 + H2O H2SO4 + 2HCl
 2NaCl крист + H2SO4 конц T Na2SO4 + 2HCl
2NaCl крист + H2SO4 конц T Na2SO4 + 2HCl
 BaCl2 + H2SO4 2HCl + BaSO4¯
BaCl2 + H2SO4 2HCl + BaSO4¯
физ.свойства хлороводорода
2. газ без цвета-с резким запахом,растворим H2O
3. (н.у.) неактивен
*водный раствор - кислота
 * восстановитель
* восстановитель
*реакции с органическими в-вами
свойства соляной кислоты
СОЛЯНАЯ КИСЛОТА HCl водный раствор HCl
2. жидкость без цвета-запах хлорововодорода-дымит
3. сильная кислота
*электролитическая диссоциация
HCl ® H+ + Cl-
*рН<7 цвет индикаторов лакмус + H+ фенолфталеин + H+ метилоранж + H+






реакции замещения с металлами до Н
*2HCl + Mg ® MgCl2 + H2
 2H+ + Mg Mg2+ + H2
2H+ + Mg Mg2+ + H2
реакции обмена с основными оксидами
*2HCl + CaO ® H2O + CaCl2
реакции обмена с основаниями-солями (условия необратимости реакции..)
*HCl + NaOH ® NaCl + H2O реакция нейтрализации эквивалентных количеств H+ и OH-
*ZnS + 2HCl ® ZnCl2 + H2S сильные кислоты вытесняют слабые из их солей
 *Ag+ + Cl- AgCl¯белый HNO3
*Ag+ + Cl- AgCl¯белый HNO3
качественная реакция ряд к-т H2SO4,HCl,H2SO3,H2CO3,H2S,H2SiO3
осадок нерастворим в воде-кислотах H3PO4
восстановитель
 *16HCl + 2KMnO4 5Cl2 + 2KCl + 2MnCl2 + 8H2O
*16HCl + 2KMnO4 5Cl2 + 2KCl + 2MnCl2 + 8H2O
 4HCl + MnO2 Т MnCl2 + Cl2 + 2H2O
4HCl + MnO2 Т MnCl2 + Cl2 + 2H2O
 6HCl + KСlO3 KCl + 3H2O + 3Cl2
6HCl + KСlO3 KCl + 3H2O + 3Cl2
*реакции с алкенами-алкинами
СН2=СН2 + HCl ® CН3-CH2Cl хлорэтан
СН2=СН-CH3 + HCl ® CН3-CHCl-CH3
НСºСН + НCl ® AlCl3 СН2=СНCl винилхлорид
СНºС-СН3 + 2НCl ® AlCl3 СН3-СCl2-СН3
СНºС-СН=СН2 + НCl ® СН2=СCl-СН=СН2
хлоропрен
реакции со спиртами
CH3-ОН + НCl Û CH3-Cl + H2O метилхлорид
применение соляной кислоты
4. применяют при пайке(кислота очищает Me от окислов и припой ложится лучше)
получение хлоропрена CH2=CCl-CH=CH2
желудочный сок содержит соляную кислоту
применяют для компенсации низкой кислотности
соли соляной кислоты, их применение, качественная реакция на хлорид-ионы
соли Сl- хлориды - соли соляной кислоты ПР: AgCl AgNO3
2. тв.,растворимы(кроме AgCl PbCl2)
3. соли
*электролитическая диссоциация(сильные электролиты)
*гидролиз солей
*реакции замещения растворов солей с более активными металлами
*реакции обмена с кислотами-основаниями-солями(условия необратимости реакции..)
 Ag+ + Cl- AgCl¯белый качественная реакция осадок нерастворим в воде-кислотах
Ag+ + Cl- AgCl¯белый качественная реакция осадок нерастворим в воде-кислотах
 AgCl + 2NH3 [Ag(NH3)2]Cl осадок растворим в аммиачной воде
AgCl + 2NH3 [Ag(NH3)2]Cl осадок растворим в аммиачной воде
4. каменная соль NaCl употребляется в пищу
KCl калийное удобрение
строение внешнего энергетического уровня элементов главной подгруппы 6 группы
объяснить возможные степени окисления элементов
подгруппа кислорода О S Se Te Po ХАЛЬКОГЕНЫ
ПС VIА
| Tкип°C | Tплав°C | |||
| О | неметалл | О2 -183 | газ | |
| S | неметалл | S8 монокл 119 | тв. | |
| Se | неметалл | Se 217 | тв. | |
| Te | неметалл с Ме блеском,е-проводник | Te4 50 | тв. | |
| Ро | радиоактивный металл |
строение внешней е-оболочки..s2р4, р-элементы
2s 2p
 |  |  |  | ||||
1s
 |
О
+8 


 3s 3p 3d
3s 3p 3d

 2s 2p
2s 2p
 |  |  |  |
1s
 |
S
+16
элементы подгруппы кислорода – окислители и восстановители
ПР: окислитель - H2SO4конц
восстановитель - H2S
в образовании хим.связей участвуют только неспаренные е-, это валентные электроны, образующие общие пары е-
степень окисления - условный заряд атома в молекуле, если молекула состоит только из ионов
считают, что общая пара е- переходит к атомам с большей ЭО или делится между атомами равной ЭО,
степень окисления равна количеству отданных(принятых) е-,
в простых в-вах атомы имеют степень окисления 0,
в соединениях степень окисления меняется, потому что меняется количество неспаренных е-:
при возбуждении е- распариваются и переходят от s- или р-орбиталей на свободные d-орбитали(кроме О),
поэтому атомы подгруппы имеют ст.окисления и валентность кислород 0 –1 -2 +2
сера 0 -2 +2 +4 +6
селен 0 -2 +4 +6
как правило, кислород имеет степень окисления –2, кроме соединений с фтором, где степень окисления +2,
у пероксидовкислород имеет степень окисления -1
«элементы главных подгрупп проявляют сходную степень окисления»
(физ.смысл) элементы главных подгрупп отдают “s”-“р”e- внешнего эн.уровня,
имея общую структуру валентных е-, они проявляют сходную степень окисления,
номер группы, как правило, равен max(+)степени окисления хим.элементов данной группы
ПР: VIА max(+)степень окисления +6 (кроме О +2)
с ростом величины порядкового номера в главной подгруппе окислительные свойства ¯
(физ.смысл)при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «О - Te»
водородные соединения и оксиды элементов подгруппы халькогенов и их свойства
водородные соединения
| H2R | Tкип°C | |||
| H2O | жидкость | амфотерное в-во | восстановители | |
| H2S | газ | растворы–кислоты | ||
| H2Se | газ | |||
| H2Te | газ | |||
H2S H2Se H2Te - летучие соединения с полярной ковалентной связью, H2O - жидкость
H2Se H2Te легко разлагаются при нагревании
с ростом порядкового номера в главной подгруппе прочность водородных соединений ¯
(физ.смысл) размеры атомов , слабеет их связь с атомами водорода
H2O - амфотерное соединение
водные растворы H2S H2Se H2Te – слабые кислоты
с ростом порядкового номера в главной подгруппе кислотные свойства водородных соединений
(физ.смысл) размеры атомов , прочность водородных соединений уменьшается,
усиливается эл.диссоциация Н2(неМе)®Н+ + НнеМе-
H2S – восстановитель
с ростом порядкового номера в главной подгруппе восстановительные свойства водородных соединений
(физ.смысл) размеры атомов , прочность водородных соединений уменьшается,
размеры атомов , слабеет связь валентных е- с ядром атома,
в итоге, при разрушении водородные соединения легче отдают электроны
 |  |
Н+ Н+
 | |||
 | |||
 неМе- Н+
неМе- Н+
неМе- Н+ 
 |
высшие оксиды
| RO3 | |||
| SO3 | жидкости | кислотные ® кислоты | кислоты-окислители |
| SeO3 | |||
| TeO3 | |||
с ростом порядкового номера в главной подгруппе сила кислородсодержащих кислот ¯
(физ.смысл) атомы О у центр.атома смещают е- плотность связи Н-О,
при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры центр.атома , уменьшается смещение е- плотности, эл.диссоциация уменьшается
кислород, электронное строение атома кислорода
валентность, степени окисления
кислород 2s 2p
 |  |  |  |
1s
 |
О
+8
ПС №8 2период VIА
строение е-оболочек +8О 1s22s2р4, р-элемент,
как правило, кислород – окислитель,
О 0 + e- ® О -
О 0 + 2e- ® О -2
О 0 - 2e- ® О +2
ст.окисления 0 –1 -2 +2
ПР:
как правило, кислород имеет степень окисления –2 и валентность II,
кроме соединений с фтором, где степень окисления +2, и пероксидов, где степень окисления -1
ПР: H2О H2О2 F2О
кислород широко распространен в природе ПР: 47% от массы земной коры(самый распространенный),
90% от массы Мирового океана,
21% от объема атмосферного воздуха,
физ. и хим.свойства аллотропных модификаций кислорода, их взаимный переход
у кислорода есть варианты простых в-в(есть аллотропия) - кислород и озон,
кислород и озон различны по физ.свойствам:
2. O2 кислород газ без цвета–запаха-вкуса,¯растворим H2O, TкипО2=-183°C
в жидком состоянии проявляет парамагнитные свойства(в молекуле есть неспаренные е-)
O3 озон газ с резким запахом, ¯растворим H2O, тяжелее O2 TкипО3=-112°C
кислород и озон различны по хим.свойствам:
3. озон О3 неметалл, активнее кислорода О2, окисляет Au Pt KI H2S PbS
окислитель О3 ® О2 + О
2KI + О3 + H2O ® 2KOH + I2 + О2 качественная реакция (если добавить крахмал, то он посинеет)
4О3 + 3H2S ® 3H2SO4
4О3 + 3PbS ® 3PbSO4
взаимный переход кислорода и озона
 3O2 грозовой разряд-УФЛ 2O3
3O2 грозовой разряд-УФЛ 2O3
электроразряд 3О2 ® 2О3
О3 ® О2 + О
получение кислорода в лаборатории и промышленности
КИСЛОРОД О2
1.1. в воздухе, есть круговорот O, где фотосинтез 6СО2 + 6H2O ® C6H12O6 + 6O2(хлорофилл, свет)
 1.2. 2H2О электролиз 2H2 + О2 (в присутствии..)
1.2. 2H2О электролиз 2H2 + О2 (в присутствии..)
 2H2O2 MnO2 2H2O + O2
2H2O2 MnO2 2H2O + O2
 2HgO Т 2Hg + O2
2HgO Т 2Hg + O2
 2KClO3 Т МnO2 2KCl + 3O2
2KClO3 Т МnO2 2KCl + 3O2
 2KMnO4 Т K2MnO4 + MnO2 + O2
2KMnO4 Т K2MnO4 + MnO2 + O2
 4K2Cr2O7 Т 4K2CrO4 + 2Cr2O3 + 3O2
4K2Cr2O7 Т 4K2CrO4 + 2Cr2O3 + 3O2
 2KNO3 Т 2KNO2 + O2
2KNO3 Т 2KNO2 + O2
1.3. сжижение воздуха (TкипO2=-183°C TкипN2=-196°C)
хим.свойства кислорода
3. неметалл (кислород не реагирует He Ne Ar Au Ag F2 Cl2 KI..)
окислитель
 *O2 + Ca 2CaO
*O2 + Ca 2CaO
 O2 + 2Na Na2O2 пероксиды натрия
O2 + 2Na Na2O2 пероксиды натрия
 2O2 + 2К К2O4 надпероксид калия
2O2 + 2К К2O4 надпероксид калия
 2Mg + O2 2MgO (нач/нагревание)
2Mg + O2 2MgO (нач/нагревание)
 2Cu + O2 T 2CuO
2Cu + O2 T 2CuO
*2H2 + O2 ® 2H2O горение или взрыв, если смесь 2VН2/1VО2(нач/нагревание 300°C)

 О2 + С СО2 горение (нач/нагревание..°C) 2C + O2недостаток 2CО
О2 + С СО2 горение (нач/нагревание..°C) 2C + O2недостаток 2CО
 O2 + S SO2 горение (нач/нагревание 250°C)
O2 + S SO2 горение (нач/нагревание 250°C)
 5O2 + 4P 2P2O5 горение
5O2 + 4P 2P2O5 горение
 *2CO + O2 2CО2
*2CO + O2 2CО2
2SO2 + O2 450°С Û Pt V2O5 2SO3 + Q
 *2H2S + O2недостаток 2H2O + 2S
*2H2S + O2недостаток 2H2O + 2S
 2H2S + О2 2SO2 + H2O
2H2S + О2 2SO2 + H2O
 *4NH3 + 3O2 2N2 + 6H2O
*4NH3 + 3O2 2N2 + 6H2O
 4NH3 + 5O2 Pt 4NО + 6H2О
4NH3 + 5O2 Pt 4NО + 6H2О
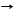 *4FeS2 + 11O2 T 2Fe2O3 + 8SO2
*4FeS2 + 11O2 T 2Fe2O3 + 8SO2
 2CuS + 3O2 T 2CuO + 2SO2
2CuS + 3O2 T 2CuO + 2SO2
 Na2S + 2O2 T Na2SO4
Na2S + 2O2 T Na2SO4
*окисление углеводородов-белков-жиров-углеводов..
 2C2H2 + 5O2 4CO2 + 2H2O горение
2C2H2 + 5O2 4CO2 + 2H2O горение
роль кислорода в природе и применение в промышленности
4. кислород вызывает разрушение(коррозию) металлов
кислород необходим для горения топлива (печи, ТЭС, двигатели)
кислород применяется в металлургии для интенсификации хим.процессов (домны, конвекторы)
в "ацетиленовой горелке" для сварки-резания
в ракетных двигателях как окислитель топлив (H2 + O2)
кислород необходим для аэробного дыхания, гниения органических остатков
кислород применяют для компенсации О2недостаточности (медицина, авиация, космос, акваланг)
воздух, его состав
воздух - смесь газов, образующих атмосферу Земли
 |
состав воздуха: азот 78%V N2 75%m
кислород 21 О2 23 постоянные компоненты воздуха
инертные газы 1 Ar Ne He Kr Xe 1,3
 |
углекислый газ 0,02-0,04 СО2 0,05 переменные компоненты воздуха
водяные пары 3 H2O
случайные компоненты: SO3, H2S..
природные механизмы поддерживают состав воздуха постоянным ПР: круговорот С, круговорот О
основные загрязнители воздуха:
- сжигание топлива: на транспорте-на ТЭС ® СО2, NO, NO2
сжигание мусора
пром.выбросы: цементные заводы CaCO3 ® CaO + CO2
металлургические С + О2 ® СО2
хим.промышленность ® SО 2, NO 2 ________
выбросы в воздух копоть, пыль
углекислый газ(парниковый эффект)
озон¯(озоновые дыры)
кислотные оксиды(кислотные дожди)
+ атмосферные явления (ветер, дожди)® распространение загрязнения по всей планете - глобальная проблема
сера, возможные степени окисления
сера 3s 3p 3d
2s 2p
 | |||||||
 |  |  | |||||
1s
 |
S
+16
ПС №16 3период VIА
строение е-оболочек +16S 1s22s2p63s2р4d0, р-элемент,
при возбуждении е- распариваются и переходят от s- и р-орбиталей на свободные d-орбитали,
возможна гибридизация,
сера – окислитель и восстановитель,
S 0 + 2e- ® S -2
S 0 - 2e- ® S +2
S 0 - 4e- ® S +4
S 0 - 6e- ® S +6
ст.окисления 0 -2 +2 +4 +6
ПР: S H2S SCl2 H2SO3 H2SO4
окислительно-восстановительные свойства соединений серы
окислители - H2SO4 конц атомы max степени окисления
восстановители - H2S2- атомы min степени окисления
окислители и восстановители S SO2 атомы в промежуточной степени окисления
природные соединения серы
в природе сера встречается в виде хим.соединений и в виде простых в-в(есть аллотропия)
ПР: H2S сероводород
CaSO4*2H2O гипс
MgSO4*7H2O горькая соль
Na2SO4*10H2O глауберова соль
PbS свинцовый блеск
Cu2S медный блеск
ZnS цинковая обманка
FeS2 пирит, железный колчедан
физ.свойства аллотропных модификаций серы
аллотропия:
S8 сера ромбическая (молекулярная крист.решётка) тв.кристал-жёлтая,´растворима H2O
S — S (II) 0 хим.связь неполярная ковалентная TплавS=112°C
/ \ устойчива при <96°C
S S
| |
S S
\ /
S — S
S8 сера моноклинная кристаллическая (молекулярная крист.решётка) тв.кристал-светлая,´растворима H2O
S (II) 0 хим.связь неполярная ковалентная образуется при >96°C, TплавS=119°C
 S S неустойчива при <96°C
S S неустойчива при <96°C
S S (переходит в ромбическую серу)
S
S S
сера пластическая (линейная полимерная структура) тв.аморфная «резина»-жёлтая,´растворима H2O
S S (II) 0 хим.связь неполярная ковалентная образуется при быстром охлаждении расплава серы
\ / \ / \ / неустойчива
S S S (переходит в ромбическую серу)
хим.свойства серы
СЕРА S
 1.2. 2H2S + O2недостаток 2H2O + 2S
1.2. 2H2S + O2недостаток 2H2O + 2S
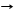 2H2S + SО2 3S + 2H2O
2H2S + SО2 3S + 2H2O
 2H2S + H2SO3 3S¯ + 3H2O
2H2S + H2SO3 3S¯ + 3H2O
 3Zn + 4H2SO4 конц T 3ZnSO4 + S + 4H2O
3Zn + 4H2SO4 конц T 3ZnSO4 + S + 4H2O
 H2S + H2SO4 конц S + SО2 + 4H2O
H2S + H2SO4 конц S + SО2 + 4H2O
 SO2 + C T S + CO2
SO2 + C T S + CO2
1.3. выплавление серы из пород водяным паром
3. неметалл (сера не реагирует He-Ne-Ar-Au Pt Ir..)
окислитель
*реакции с металлами
 S + 2Na Na2S
S + 2Na Na2S
 S + Hg HgS
S + Hg HgS
 S + Fe T FeS
S + Fe T FeS
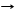 3S + 2Al T Al2S3
3S + 2Al T Al2S3
*реакции с неметаллами
H2 + S T Û H2S очистка нефти от серы
 2S + C T CS2 сероуглерод
2S + C T CS2 сероуглерод
 3S + 2P T P2S3 трисульфид фосфора (при нагревании без доступа воздуха-кислорода)
3S + 2P T P2S3 трисульфид фосфора (при нагревании без доступа воздуха-кислорода)
восстановитель
 S + О2 SО2 горение(нач/нагревание 250°C)
S + О2 SО2 горение(нач/нагревание 250°C)
 S + Cl2 SCl2
S + Cl2 SCl2
 S + F2 SF6 или SF2 или SF4
S + F2 SF6 или SF2 или SF4
*реакции с кислотами-окислителями
 S + 2HNO3 H2SO4 + 2NO
S + 2HNO3 H2SO4 + 2NO
 S + 6HNO3 конц H2SO4 + 6NO2 + 2H2O
S + 6HNO3 конц H2SO4 + 6NO2 + 2H2O
 S + 2H2SO4 конц 3SO2 + 2H2O
S + 2H2SO4 конц 3SO2 + 2H2O
реакции диспропорционирования с щелочами, где сера окислитель и восстановитель
 *3S + 6NaOH 2Na2S + Na2SO3 + 3H2O
*3S + 6NaOH 2Na2S + Na2SO3 + 3H2O
применение серы
4. получение резины(вулканизация каучука), изготовление спичек-пороха
получение серной кислоты H2SO4
применяется в составе серной мази для лечения кожных болезней
применяется для уничтожения насекомых
сероводород: получение и физ.свойства
СЕРОВОДОРОД H2S
1.1. гниение белков, минеральные воды

 1.2. FeS + 2HCl FeCl2 + H2S
1.2. FeS + 2HCl FeCl2 + H2S
Al2S3 + 6Н2О 2Al(OH)3 + 3H2S
H2 + S T Û H2S очистка нефти от серы
2. газ без цвета-с резким запахом «тухлых яиц»(ядовит), растворим в Н2О
водный раствор H2S - жидкость без цвета-с запахом сероводорода СЕРОВОДОРОДНАЯ КИСЛОТА H2S
3.1. H2S H
\
S(II) -2 хим.связь полярная ковалентная(Ð92°)
/ межмолекулярные водородные связи не образуются(малая ЭО и большой размер атома S)
H
хим.свойст
Дата добавления: 2015-07-25; просмотров: 87 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Триада железа Fe Co Ni | | | S 3p 3d |