





2s 2p
 |  |  |
1s
 |
Р
+15
элементы подгруппы азота – окислители и восстановители
ПР: окислитель - HNO3
восстановитель - NH3
валентность есть число хим.связей, которыми атом соединен с другими атомами
валентность обозначает число общих электронных пар, которыми атом связан с другими атомами,
в образовании хим.связей участвуют только неспаренные е-, это валентные электроны,
валентность определяется числом валентных электронов и числом орбиталей на энергетическом уровне,
валентность элементов меняется, потому что в атомах меняется число валентных е-:
у атомов в возбужденном состоянии валентных е- больше, чем в основном состоянии,
при возбуждении атома происходит распаривание электронов и их переход на другие орбитали
ПР: в СН4 валентность С(IV)
если образуется донорно-акцепторная ковалентная связь, то валентность больше числа неспаренных е-
ПР: в NH4+ валентность N(IV),
но высшая валентность не может быть больше числа орбиталей на энергетическом уровне
ПР: высшая валентность фосфора Р(V),
высшая валентность N(IV), больше IV высшей валентности быть не может,
причина - число орбиталей на втором эн.уровне 4,
N не имеет свободных орбиталей для распаривания е- при возбуждении
валентные электроны образуют общие пары е-
степень окисления - условный заряд атома в молекуле, если молекула состоит только из ионов
считают, что общая пара е- переходит к атомам с большей ЭО или делится между атомами равной ЭО,
степень окисления равна количеству отданных(принятых) е-,
в простых в-вах атомы имеют степень окисления 0,
в соединениях степень окисления меняется, потому что меняется количество неспаренных е-:
при возбуждении е- распариваются и переходят от s- или р-орбиталей на свободные d-орбитали(кроме N),
если образуется донорно-акцепторная ковалентная связь, то степень окисления больше числа неспаренных е-
ПР: в молекуле азотной кислоты НNО3 степень окисления N +5
«элементы главных подгрупп проявляют сходную степень окисления»
(физ.смысл) элементы главных подгрупп отдают “s”-“р”e- внешнего эн.уровня,
имея общую структуру валентных е-, они проявляют сходную степень окисления,
ст.окисления азота 0 –3 –2 -1 +1 +2 +3 +4 +5
фосфора 0 –3 +1 +3 +5
номер группы, как правило, равен max(+)степени окисления хим.элементов данной группы
ПР: VА max(+)степень окисления +5
с ростом величины порядкового номера в главной подгруппе окислительные свойства элементов ¯
(физ.смысл) при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «N - Bi»
водородные соединения и оксиды элементов подгруппы азота
водородные соединения
| RH3 | Tкип °C | |||
| NH3 | -33 | газ | растворы–слабые основания | восстановители |
| PH3 | газ | |||
| AsH3 | тв. | |||
| SbH3 | ||||
| BiH3 |
NH3, PH3 - летучие соединения с полярной ковалентной хим.связью,
связи N и P с водородом прочнее, чем у соединений подгруппы кислорода и галогенов,
в результате водные растворы NH3 и PH3 не имеют кислотных свойств,
NH3, PH3 реагируют с водой с образованием ионов ОН- и проявляют свойства слабых оснований
ПР: NH3 + H2O Û NH4+ + OH-,
с ростом порядкового номера в главной подгруппе основные свойства водородных соединений ¯
(физ.смысл) при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , электроотрицательность ¯,
реакция с водой идет менее активно и меньше образуется ионов ОН-
с ростом порядкового номера в главной подгруппе восстановительные свойства водородных соединений
(физ.смысл) размеры атомов ,
уменьшается прочность водородных соединений и слабеет связь валентных е- с ядром атома
высшие оксиды
| R2O5 | |||
| N2O5 | тв. | кислотный ® кислоту | кислоты-окислители |
| P2O5 | тв. | кислотный ® кислоту | |
| As2O5 | амфотерный | ||
| Sb2O5 | амфотерный | ||
| Bi2O5 | основный |
с ростом порядкового номера в главной подгруппе сила кислородсодержащих кислот ¯
(физ.смысл) атомы О у центр.атома смещают е- плотность связи Н-О,
при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры центр.атома , уменьшается смещение е- плотности, эл.диссоциация уменьшается
электронное строение атома азота, степени окисления
азот 2s 2p
 |  |  |
1s
 |
N
+7
ПС №7 2период VА
строение е-оболочек +7N 1s22s2р3, р-элемент,
азот – окислитель и восстановитель ПР: окислитель - HNO3, восстановитель - NH3
N 0 + 3e- ® N -3
N 0 - 2e- ® N +2
N 0 - 5e- ® N +5
ст.окисления 0 –3 –2 -1 +1 +2 +3 +4 +5
ПР: N2 NH3 N2H4 гидразин NН2ОН гидроксиламин N2О NО N2О3 NО2 N2О5
получение и физ.свойства азота
строение молекулы азота, связь строения и хим.активности
хим.свойства азота
АЗОТ N2
1.1. воздух(78%V N2 75%m)
 1.2.*NH4NO2 T N2 + 2H2O
1.2.*NH4NO2 T N2 + 2H2O
 4NH3 + 3Br2 2N2 + 6NH4Br
4NH3 + 3Br2 2N2 + 6NH4Br
1.3.*сжижение воздуха (TкипO2=-183°C TкипN2=-196°C)
2.(н.у.)газ газ без цвета–запаха-вкуса,¯растворим H2O, TкипN2=-196°C
3.1. N2 N º N(III) 0 хим.связь тройная неполярная ковалентная 1р-p s-связь + 2p-p p-связи
3. неметалл (неактивен из-за прочной тройной связи)
окислитель
 *N2 + 2Li 2Li3N
*N2 + 2Li 2Li3N
 N2 + 3Mg Т Mg3N2 нитрид магния
N2 + 3Mg Т Mg3N2 нитрид магния
N2 + 3Н2 T p Û Кt 2NH3 + Q
восстановитель
*N2 + О2 3000°С Û 2NО - Q
физ.свойства аммиака, строение молекулы аммиака, характер связей
АММИАК NH3
 1.2. 2NH4Cl + Ca(OН)2избыток T CaCl2 + 2NH3 + 2H2O
1.2. 2NH4Cl + Ca(OН)2избыток T CaCl2 + 2NH3 + 2H2O
1.3. N2 + 3Н2 T p Û Fe + Al2O3 K2O 2NH3 + Q для смещения хим.равновесия T400-500°C р30-100 МПа
 2.(н.у.) газ без цвета-резкого запаха, легче воздуха,растворим H2O, ТкипNH3=-33°C
2.(н.у.) газ без цвета-резкого запаха, легче воздуха,растворим H2O, ТкипNH3=-33°C
3.1. NH3 N(III) -3 хим.связь одинарная полярная ковалентная s (sp3 Ð107°) «пирамида»
образует водородные связи(имеет высокую Ткип)
хим.свойства аммиака
3. *реакция разложения
 2NH3 T N2 + 3Н2 N2 + 3Н2 T p Û Fe + Al2O3 K2O 2NH3 + Q
2NH3 T N2 + 3Н2 N2 + 3Н2 T p Û Fe + Al2O3 K2O 2NH3 + Q
восстановитель (min степень окисления)
 *4NH3 + 3O2 2N2 + 6H2О
*4NH3 + 3O2 2N2 + 6H2О
 4NH3 + 5O2 T p Pt 4NО + 6H2О
4NH3 + 5O2 T p Pt 4NО + 6H2О
 4NH3 + 3Br2 2N2 + 6NH4Br
4NH3 + 3Br2 2N2 + 6NH4Br
 *2NH3 + 3CuO T 3Cu + N2 + 3H2O
*2NH3 + 3CuO T 3Cu + N2 + 3H2O
окислитель
 *2NH3 + 2Na T 2NaNH2 + H2 амид натрия
*2NH3 + 2Na T 2NaNH2 + H2 амид натрия
*NH3 + H2O Û NH3*H2O гидрат аммиака Û NH4+ + OH- аммиачная вода(10% р-р аммиака есть нашатырный спирт)
 водный раствор аммиака - слабое основание
водный раствор аммиака - слабое основание
 *NH3 + HCl NH4Cl
*NH3 + HCl NH4Cl
 2NH3 + H2SO4 (NH4)2SO4
2NH3 + H2SO4 (NH4)2SO4
 AlCl3 + 3NH4OH Al(OH)3¯ + 3NH4Cl
AlCl3 + 3NH4OH Al(OH)3¯ + 3NH4Cl
 CuSO4 + 4NH3 [Cu(NH3)4]SO4
CuSO4 + 4NH3 [Cu(NH3)4]SO4
 AgCl + 2NH3 [Ag(NH3)2]Cl растворение в аммиачной воде
AgCl + 2NH3 [Ag(NH3)2]Cl растворение в аммиачной воде
 2NH3 + СO2 T p (NH2)2СO + H2O карбамин или мочевина
2NH3 + СO2 T p (NH2)2СO + H2O карбамин или мочевина


применение аммиака
4. получение нашатырного спирта 10% NH4OH
азотной кислоты HNO3
азотных удобрений
свойства солей аммония, качественная реакция на ион аммония
соли NH4+ соли аммония – соли аммиака ПР: NH4Cl (NH4)3PO4 NH4H2PO4
1.2. 2NH3 + H2SO4 ® (NH4)2SO4
2NH4OН + H2SO4 ® (NH4)2SO4 + 2H2O
2. тв.кристал.,растворим H2O
3. соли
*электролитическая диссоциация
NH4Cl ® NH4+ + Cl- ион аммония
реакции гидролиза
*NH4Cl + H2O ® NH3*H2O + H+ + Cl-(рН<7)
реакции обмена с кислотами-основаниями-солями(условия необратимости реакции..)
*(NH4)2CO3 + 2HCl ® 2NH4Cl + H2O + CO2
*NH4Cl + NaOH ® NaCl + H2O + NH3 запах аммиака качественная реакция
*(NH4)2SO4 + BaCl2 ® BaSO4¯ + 2NH4Cl
*реакции разложения
 NH4Cl T NH3 + HCl
NH4Cl T NH3 + HCl
(NH4)2SO4 T ® NH3 + 2NH4НSO4
реакции разложения и окисления
 NH4NO3 T N2O + 2H2O
NH4NO3 T N2O + 2H2O
 (NH4)2Cr2O7 T N2 + Cr2O5 + 4H2O
(NH4)2Cr2O7 T N2 + Cr2O5 + 4H2O
оксиды азота, получение и свойства оксида азота(II) и оксида азота(IV)
ОКСИД АЗОТА (I) N2О
 1.2. NH4NO3 T N2O + 2H2O
1.2. NH4NO3 T N2O + 2H2O
2. газ без цвета, растворим H2O
3. несолеобразующий оксид (не реагирует с водой-шелочами)
окислитель
 *2N2O + H2 2N2 + H2O
*2N2O + H2 2N2 + H2O
*реакция разложения
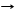 2N2O T 2N2 + O2
2N2O T 2N2 + O2
ОКСИД АЗОТА (II) NО
1.2.  8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O
8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O
 1.3. 4NH3 + 5O2 T p Pt 4NO + 6H2O + Q
1.3. 4NH3 + 5O2 T p Pt 4NO + 6H2O + Q
 N2 + O2 гроза 2NO
N2 + O2 гроза 2NO
3. несолеобразующий оксид (не реагирует с водой-шелочами)
окислитель
 *2NO + SО2 2SO3 + N2
*2NO + SО2 2SO3 + N2
 2NO + 2H2O + 2SО2 2Н2SO4 + N2
2NO + 2H2O + 2SО2 2Н2SO4 + N2
восстановитель
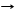 *2NO + О2 2NO2
*2NO + О2 2NO2
ОКСИД АЗОТА (III) N2О3
1.2. NО2 + NО Û N2О3
3. кислотный оксид нестойкий(азотистая кислота нестойкая, соли нитриты стойкие)
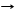 *2KOH + N2О3 H2O + 2KNO2 нитрит калия
*2KOH + N2О3 H2O + 2KNO2 нитрит калия
*реакции разложения
N2О3 Û NО2 + NО
ОКСИД АЗОТА (IV) NО2 и N2О4
1.2.  4HNO3 конц + Cu Cu(NO3)2 + 2H2O + 2NO2бурый
4HNO3 конц + Cu Cu(NO3)2 + 2H2O + 2NO2бурый
 2Cu(NO3)2 T 2CuO + 4NO2 + O2
2Cu(NO3)2 T 2CuO + 4NO2 + O2
1.3. 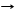 2NO + О2 2NO2
2NO + О2 2NO2
2. газ бурый-с резким запахом(ядовит)
3.1. мономер 2NО2 -11°C Û N2О4 димер
3. кислотный оксид
 *2NO2 + Н2О холод HNO3 + HNО2 реакция диспропорционирования
*2NO2 + Н2О холод HNO3 + HNО2 реакция диспропорционирования
 3NO2 + Н2О Т 2НNO3 + NО
3NO2 + Н2О Т 2НNO3 + NО
 4NO2 + 2Н2О + О2 4НNO3
4NO2 + 2Н2О + О2 4НNO3
 *2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
*2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
 4NO2 + 4NaOH + О2 4NaNO3 + 2H2O
4NO2 + 4NaOH + О2 4NaNO3 + 2H2O
окислитель
 *2C + 2NO2 2CO2 + N2
*2C + 2NO2 2CO2 + N2
 2NO2 + SО2 SO3 + NО
2NO2 + SО2 SO3 + NО
ОКСИД АЗОТА N2О5
 1.2. 2НNO3 + Р2О5 2НРО3 + N2О5
1.2. 2НNO3 + Р2О5 2НРО3 + N2О5
 6НNO3 + Р2О5 2Н3РО4 + 3N2О5
6НNO3 + Р2О5 2Н3РО4 + 3N2О5
2. тв.кристал
3. кислотный оксид
 N2О5 + Н2О 2НNO3
N2О5 + Н2О 2НNO3
*реакции разложения
 2N2О5 4NO2 + О2
2N2О5 4NO2 + О2
строение молекулы азотной кислоты
получение азотной кислоты
физ.свойства азотной кислоты
АЗОТНАЯ КИСЛОТА HNO3
 1.2. 2NaNO3крист + H2SO4конц Т 2HNO3 + Na2SO4
1.2. 2NaNO3крист + H2SO4конц Т 2HNO3 + Na2SO4
1.3. контактный способ хим.процессы:
- в контактном аппарате
окисление аммиака до оксида азота(II)
 4NH3 + 5O2 T p Pt 4NO + 6H2O + Q
4NH3 + 5O2 T p Pt 4NO + 6H2O + Q
- в окислительной башне
окисление оксида азота(II) до оксида азота(IV)
 2NO + O2 2NO2
2NO + O2 2NO2
- в поглотительной башне
поглощение оксида азота(IV) водой в присутствии избытка кислорода
 3NO2 + H2O 2HNO3 + NO
3NO2 + H2O 2HNO3 + NO
4NO2 + 2H2O + O2 Û 4HNO3 + Q для смещения хим.равновесия р
2.(н.у.) жидкость без цвета или желтая(конц)-запаха-дымит, растворима H2O в любых соотношениях,
3.1. HNO3 O
//
 H - O - N(IV) +5 хим.связи полярные ковалентные
H - O - N(IV) +5 хим.связи полярные ковалентные
три ковалентные связи образуются за счет неспаренных е-
O четвертая – донорно-акцепторная связь за счет неподеленной пары е- атома азота
(третий атом кислорода образует свободную р-орбиталь при возбуждении)
связи с атомами кислорода, связанные только с азотом, равноценны
хим.свойства азотной кислоты, взаимодействие неорганическими и органическими веществами
3.2. сильная кислота
*электролитическая диссоциация
HNO3 ® H+ + NO3-
*рН<7 цвет индикаторов лакмус + H+ фенолфталеин + H+ метилоранж + H+






реакции обмена с основными оксидами
 *2HNO3 + CuO H2O + Cu(NO3)2
*2HNO3 + CuO H2O + Cu(NO3)2
 2H+ + CuO Cu2+ + H2O
2H+ + CuO Cu2+ + H2O
реакции обмена с основаниями-солями(условия необратимости реакции..)
 *HNO3 + NaOH NaNO3 + H2O реакция нейтрализации H+ + OH-® H2O
*HNO3 + NaOH NaNO3 + H2O реакция нейтрализации H+ + OH-® H2O
сильные кислоты вытесняют слабые и летучие из их солей

 *Na2CO3 + 2HNO3 2NaNO3 + H2O + CO2 HNO3
*Na2CO3 + 2HNO3 2NaNO3 + H2O + CO2 HNO3
*реакция разложения ряд к-т H2SO4,HCl,H2SO3,H2CO3,H2S,H2SiO3
 4HNO3 T 4NO2 + O2 + 2H2O(или на свету) H3PO4
4HNO3 T 4NO2 + O2 + 2H2O(или на свету) H3PO4
* окислитель (max степень окисления)
не реагирует с Au-Pt-Os-Ir-W..
 +5 HNO3
конц +5 HNO3
конц
| металлы «Ni-Н-Ag» и неметаллы ® +4 NO2 металлы «Al,Zn,Fe» ® +4 NO2 металлы «Li–Mg» ® +1 N2O |
| +5 HNO3 разбавл | металлы «Ni-Н-Ag» и неметаллы ® +2 NO металлы «Al,Zn,Fe» ® +2 NO -3 NH4NO3 металлы «Li–Mg» ® -3 NH4NO3 |
 8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O
8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O
 4HNO3 конц + Cu Cu(NO3)2 + 2NO2бурый + 2H2O качественная реакция
4HNO3 конц + Cu Cu(NO3)2 + 2NO2бурый + 2H2O качественная реакция
 2HNO3 + S H2SO4 + 2NO
2HNO3 + S H2SO4 + 2NO
 6HNO3 конц + S H2SO4 + 6NO2 + 2H2O
6HNO3 конц + S H2SO4 + 6NO2 + 2H2O
 5HNO3 + 3P + 2H2O 3H3PO4 + 5NO
5HNO3 + 3P + 2H2O 3H3PO4 + 5NO
 5HNO3 конц + P H3PO4 + 5NO2 + H2O
5HNO3 конц + P H3PO4 + 5NO2 + H2O
 4HNO3 + 3C 3CO2 + 4NO + 2H2O
4HNO3 + 3C 3CO2 + 4NO + 2H2O
 4HNO3 конц + C CO2 + 4NO2 + 2H2O
4HNO3 конц + C CO2 + 4NO2 + 2H2O
 10HNO3 + 3I2 6HIO3 + 10NO + 2H2O
10HNO3 + 3I2 6HIO3 + 10NO + 2H2O
 8HNO3 конц + ZnS ZnSO4 + + 8NO2 + 4H2O
8HNO3 конц + ZnS ZnSO4 + + 8NO2 + 4H2O
 2HNO3 конц + 6HCl 2NO + 4H2O + 3Cl2
2HNO3 конц + 6HCl 2NO + 4H2O + 3Cl2
 «царская водка»(3V HCl конц/1V HNO3 конц) HNO3 конц + 3HCl + Au AuCl3 + NO + 2H2O
«царская водка»(3V HCl конц/1V HNO3 конц) HNO3 конц + 3HCl + Au AuCl3 + NO + 2H2O
 4HNO3 конц + 12HCl + 3Pt 3PtCl4 + 4NO + 8H2O
4HNO3 конц + 12HCl + 3Pt 3PtCl4 + 4NO + 8H2O
*реакции нитрирования алканов-бензола-толуола-фенола-глицерина-целлюлозы
*реакции нитрирования алканов Коновалов
С6Н14 + НО-NO2 Т ® C6H13-NO2 + H2О
нитрогексан
*реакции нитрования бензола-толуола-фенола
NO2 NO2 NO2
 | | |
| | |
 |  | ||||||
 |  | ||||||
 + HО-NO2 Т ® H2SO4 конц + Н2O + HNO3 Т ® H2SO4 конц + Н2O
+ HО-NO2 Т ® H2SO4 конц + Н2O + HNO3 Т ® H2SO4 конц + Н2O
-NO2
нитробензол
CH3 CH3
| |
 |  |
-NO2
+ HNO3 ® H2SO4 + Н2O
OH OH
| |
 |  |
NO2- -NO2
+ 3HO-NO2 ® + 3H2O
|
NO2 2,4,6-тринитрофенол (пикриновая кислота)
*реакции нитрования глицерина
СН2-ОН СН2-О-NO2
| |
СН-ОН + 3НОNO2 H2SO4 ® СН--O-NO2 + 3H2O
| |
СН2-ОН СН2-О-NO2 нитроглицерин
*реакции нитрования целлюлозы
 |  |  |  |
/ ОН / О – NO2
(C6Н7О2)- ОН + 3nHO-NO2 ® (C6Н7О2)- О – NO2 + 3nH2O
\ ОН n \ О – NO2 n
применение азотной кислоты
4. получение азотных удобрений
красителей
лекарств
взрывчатых в-в
свойства нитратов
соли NO3- нитраты - соли азотной кислоты ПР: NaNO3, KNO3, NH4NO3
1.2.  8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O
8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O
 2HNO3 + CuO H2O + Cu(NO3)2
2HNO3 + CuO H2O + Cu(NO3)2
 Na2CO3 + 2HNO3 2NaNO3 + H2O + CO2
Na2CO3 + 2HNO3 2NaNO3 + H2O + CO2
 HNO3 + NaOH NaNO3 + H2O
HNO3 + NaOH NaNO3 + H2O
 HNO3 + NH3 NH4NO3
HNO3 + NH3 NH4NO3
2. тв.кристал,растворимы H2O
3. соли
*электролитическая диссоциация
КNO3 ® К+ + NO3-
*реакции замещения растворов солей с более активными металлами
*реакции обмена с кислотами-основаниями-солями(условия необратимости реакции..)
*гидролиз солей
*реакции разложения
| +5 Me NO3 | «Li,K,Na,Ba» ® Me NO2 + O2 «Ca,Mg-Cu» ® Me O + NO2 + O2 «Hg-Au» ® Me + NO2 + O2 |
 2NaNO3 T 2NaNO2 + O2
2NaNO3 T 2NaNO2 + O2
 2Cu(NO3)2 T 2CuO + 4NO2 + O2
2Cu(NO3)2 T 2CuO + 4NO2 + O2
 2AgNO3 T 2Ag + NO2 + O2
2AgNO3 T 2Ag + NO2 + O2
 NH4NO3 T N2O + 2H2O
NH4NO3 T N2O + 2H2O
применение нитратов, азотные удобрения
4. получение азотных удобрений
минеральные удобрения
*1840 Ю.Либих "теория минерального питания растений"
- для питания растений необходимы питательные в-ва, содержащие макро и микроэлементы
ПР: макроэлементы(C-O-H-N-P-K-S-Ca), микроэлементы(Fe-Mn-B-Cu-Zn-Mg-Co..)
- источник С есть СО2, источник Н-О есть Н2О, источник остальных элементов есть в-ва почвы
- растения используют питательные в-ва почвы в виде ионов: K+, NH4+… и NO3-, HPO4-…
- при недостатке питательных в-в у растений развиваются болезни
ПР: при недостатке N ® задержка роста, окрашивание бледно-зелёное или жёлтое
при недостатке P ® задержка развития цветков плодов
при недостатке K ® задержка накопления углеводов в плодах
- при недостатке питательных в-в нужно вносить в почву минеральные удобрения,
различают макроудобрения(содержат макроэлементы N-P-K..) и микроудобрения(содержат микроэлементы..),
различают удобрения простые(содержат 1 пит.элемент) и комплексные,
комплексные удобрения содержат 2-3 пит.элемента
ПР: сложное удобрение аммофос N H4H2 P O4+(N H4)2Н P O4
азотные
Na N O3 натриевая селитра
1.3. месторождения Ю.Америки
при производстве НNO3 путем пропускания NO-NO2 ч/з Na2CO3
Na2CO3 + 2NO2 ® NaNO3 + NaNO2 + CO2
K N O3 калиевая селитра
месторождения Ср.Азии
KCl + NaNO3 T Û NaCl + KNO3(нагревание Т100°С)
N H4 N O3 аммиачная селитра
NH3 + HNO3 ® NH4NO3
(N H4)2SO4 сульфат аммония
2NH3 + H2SO4 ® (NH4)2SO4
CO(N H2)2 мочевина
CO2 + 2NH3 T ® CO(N H2)2 + H2O(нагревание, р)
электронное строение фосфора, степени окисления и валентности
Дата добавления: 2015-07-25; просмотров: 54 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Подгруппа хлора F Cl Br I ГАЛОГЕНЫ | | | Фосфор 3s 3p 3d |