
|
Читайте также: |




2s 2p
 | |||||||
 |  |  | |||||
1s
 |
Si
+14
ПС №14 3период IVА
строение е-оболочек +14Si 1s22s2р63s2р2, р-элемент,
при возбуждении е- распариваются и переходят от s-орбитали на свободные р-орбитали,
кремний – окислитель и восстановитель,
Si 0 + 4e- ® Si -4
Si 0 - 4e- ® Si +4
ст.окисления 0 –4 +4
ПР: SiO2 Si Mg2Si
кремний распространен в природе ПР: 27% от массы земной коры,
в природе кремний встречается в виде хим.соединений
ПР: SiO2 кремнезем песок, кварцевой песок, горный хрусталь
Al2O3*2SiO2*2H2O каолинит в глине
K2O*Al2O3*6SiO2 полевой шпат
получение кремния, физ.и хим.свойства кремния
КРЕМНИЙ Si
 1. 2Mg + SiO2 T 2MgO + Si
1. 2Mg + SiO2 T 2MgO + Si
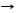 2Zn пары + SiCl4 T 2ZnCl2 + Si
2Zn пары + SiCl4 T 2ZnCl2 + Si
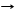 2C + SiO2 T Si + 2CO, как примесь карборунд SiC
2C + SiO2 T Si + 2CO, как примесь карборунд SiC
2. есть аллотропия:
(алмазоподобная модификация) тв.кристал-блеск-полупроводник, TплавSi=1400°C, ´растворим H2O
(аморфный кремний) тв.порошок(кристаллический кремний в высокодисперстном состоянии)
3. неметалл (неактивен)
восстановитель
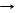 *Si + 2F2 SiF4
*Si + 2F2 SiF4
 Siаморфный + O2 T SiO2
Siаморфный + O2 T SiO2
 Si + 2Cl2 T SiCl4
Si + 2Cl2 T SiCl4
 3Si + 2N2 T Si2N4 нитрид кремния
3Si + 2N2 T Si2N4 нитрид кремния
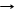 *2NaOH + Si + H2O T Na2SiO3 + 2H2
*2NaOH + Si + H2O T Na2SiO3 + 2H2
 *3Si + 4HNO3 + 12HF T 3SiF4 + 4NO + 8H2O
*3Si + 4HNO3 + 12HF T 3SiF4 + 4NO + 8H2O
 *Si + С T SiС карбид кремния (карборунд)
*Si + С T SiС карбид кремния (карборунд)
окислитель
 *Si + 2Mg T Mg2Si силицид кремния
*Si + 2Mg T Mg2Si силицид кремния
 *3Si + 2MgО T Mg2Si + 2SiО (реакция диспропорционирования)
*3Si + 2MgО T Mg2Si + 2SiО (реакция диспропорционирования)
 *Si + 2СаН2 T Са2Si + 2Н2
*Si + 2СаН2 T Са2Si + 2Н2
 *Si + 4HF T SiF4 + 2H2
*Si + 4HF T SiF4 + 2H2
применение кремния
4. в металлургии присадки Si для жаро-кислотопрочных сталей,
электронные полупроводниковые приборы
свойства оксида кремния(IV)
ОКИСЬ КРЕМНИЯ (IV) SiO2
2. (н.у.) тв. без цвета-прозрачный(кварцевое стекло), ´растворим H2O, TплавSiO2=1700°C
3.1. SiO2 | |
— O — Si — O — Si(IV) +4 хим.связь одинарная полярная ковалентная
| | ¹ атомная крист.решётка, построенная из тетраэдров SiO4
O O
| |
3. кислотный оксид (хим.устойчив)
 *SiO2 + СaO T CaSiO3 шлак
*SiO2 + СaO T CaSiO3 шлак
 BaO + SiO2 T BaSiO3
BaO + SiO2 T BaSiO3
 *SiO2 + 2NaOH T H2O + Na2SiO3 силикат натрия
*SiO2 + 2NaOH T H2O + Na2SiO3 силикат натрия
 *SiO2 + Na2CO3 T Na2SiO3 + CO2 получение стекла
*SiO2 + Na2CO3 T Na2SiO3 + CO2 получение стекла
реакции со фтором и плавиковой кислотой
 SiO2 + 2F2 SiF4 + 2O2
SiO2 + 2F2 SiF4 + 2O2
 SiO2 + 4HF SiF4 + 2H2O
SiO2 + 4HF SiF4 + 2H2O
реакции с углеродом
 2C + SiO2 T SiС + CO2 карборунд
2C + SiO2 T SiС + CO2 карборунд
 2C + SiO2 T Si + 2CO
2C + SiO2 T Si + 2CO
КРЕМНИЕВАЯ КИСЛОТА
 1.2. Na2SiO3 + 2HCl 2NaCl + H2SiO3¯, где 2H+ + SiO32-® H2SiO3¯
1.2. Na2SiO3 + 2HCl 2NaCl + H2SiO3¯, где 2H+ + SiO32-® H2SiO3¯
2.(н.у.) тв.аморфная, нерастворима H2O(образует коллоидные растворы)
3.1. группа соединений состава nSiO2*mH2O (обычно обозначают H2SiO3),
построена в виде цепи из тетраэдров SiO4
ОН ОН
| |
..— O — Si — O — Si-..(IV) +4 хим.связь одинарная полярная ковалентная
| |
OН OН
3. слабая кислота (не меняет индикаторы)
*электролитическая диссоциация ступенчатая(2-основная кислота)
H2SiO3 Û H+ + HSiO3-
HSiO3-Û H+ + SiO32-
*реакции разложения
 H2SiO3 T H2O + SiO2 образуется силикагель
H2SiO3 T H2O + SiO2 образуется силикагель
применение соединений кремния
4. силикатная промышленность - получение силикатов
силикаты – соли кремниевой кислоты ПР: Na2SiO3 CaSiO3
2. тв., ´растворимы H2O(кроме Na2SiO3 K2SiO3 "растворимое стекло")
3. соли слабой кислоты
*электролитическая диссоциация
Na2SiO3 ® 2Na+ + SiO32-
*реакции гидролиза
Na2SiO3 + H2O Û 2Na+ + 2OH- + H2SiO3¯
*реакции замещения растворов солей с более активными металлами
реакции обмена с кислотами-солями-основаниями(условия необратимости реакции..)
*Na2SiO3 + H2O + СО2 ® Na2СO3 + Н2SiO3¯ сильные кислоты вытесняют слабые из их солей
SiO32- + H2O + СО2 ® СO32- + Н2SiO3¯ HNO3
*Na2SiO3 + CaCl2 ® CaSiO3¯ + 2NaCl ряд к-т H2SO4,HCl,H2SO3,H2CO3,H2S,H2SiO3
SiO32- + Ca2+ ® CaSiO3¯ H3PO4
 *Na2SiO3 + Ca(ОН)2 CaSiO3¯ + 2NaОН
*Na2SiO3 + Ca(ОН)2 CaSiO3¯ + 2NaОН
SiO32- + Ca2+ ® CaSiO3¯
силикатная промышленность выпускает продукцию из силикатов: кирпичи, керамику, стекло, цемент
стекло
1.3. хим.процессы:
(обычное стекло=сплав соды,известняка,песка® Na2O*CaO*6SiO2)
 Na2CO3 + SiO2 T Na2SiO3 + CO2
Na2CO3 + SiO2 T Na2SiO3 + CO2
 CaCO3 + SiO2 T CaSiO3 + CO2
CaCO3 + SiO2 T CaSiO3 + CO2
(кварцевое стекло=расплав кварцевого песка SiO2)
2. тв.аморфное-прозрачное-при медленном остывании пластичное(выдувание, прокатка..)
3. хим.инертное
4. оптические линзы-окна-посуда-стекловолокно..
цемент - смесь силикатов и алюминатов Са
2. тв.порошок
3. смесь силикатов и алюминатов Са при смешивании с Н2О твердеет (как гипс)
4. строительный раствор=цемент,песок,вода м.гашеная известь
бетон=цемент,щебень,песок,вода
железобетон=бетон + каркас из арматуры
Дата добавления: 2015-07-25; просмотров: 69 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| S 3p 3d | | | Опыт №2. Получение и свойства основных оксидов |