
|
Читайте также: |
3. активный металл- восстановитель
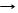 *2К + 2H2O 2КOH + H2 водород самовоспламеняется со взрывом
*2К + 2H2O 2КOH + H2 водород самовоспламеняется со взрывом
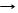 *2К + 2HCl 2КCl + H2 водород самовоспламеняется со взрывом
*2К + 2HCl 2КCl + H2 водород самовоспламеняется со взрывом
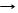 2К + 2HBr 2КBr + H2
2К + 2HBr 2КBr + H2
*К + О2 ® КO2 супероксид калия
 Cl2 + 2К 2КCl со взрывом
Cl2 + 2К 2КCl со взрывом
 S + 2К К2S
S + 2К К2S
 Н2 + 2К Т 2КН
Н2 + 2К Т 2КН
Rb Cs самовоспламеняются
4Li + 2О2 ® 2Li2O оксид лития Li2O + H2O ® 2LiOH
6Li + N2 ® 2Li3N
2Li + 2H2O ® 2LiOH + H2
оксиды, пероксиды, гидриды, гидроксиды, соли щелочных металлов – свойства
ОКСИД НАТРИЯ Na2O
1.2. Na2O2 + 2Na избыток Т ® 2Na2O без доступа кислорода
3. основной оксид
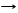 *Na2O + H2O 2NaOH
*Na2O + H2O 2NaOH
 *Na2O + СО2 Na2СO3
*Na2O + СО2 Na2СO3
 *Na2O + 2HNO3 2NaNO3 + Н2О
*Na2O + 2HNO3 2NaNO3 + Н2О
ПЕРОКСИД НАТРИЯ Na2O2
 1.2. 2O2 + 3Na Na2O2 + NaO2 пероксид натрия и супероксид натрия
1.2. 2O2 + 3Na Na2O2 + NaO2 пероксид натрия и супероксид натрия
3. Na2O2 + 2Naизбыток Т ®2Na2O оксид натрия
2Na2О2 + 2H2O ® 2NaОН + Н2О2
2Na2О2 + 2СО2 ® 2Na2СО3 + 3O2
ГИДРИД НАТРИЯ NaH
 1.2. Н2 + 2Na Т 2NaН
1.2. Н2 + 2Na Т 2NaН
3. NaH + H2O ® NaОН + Н2
NaH + HCl ® NaСl + H2
ОКСИД КАЛИЯ К2O
1.2. КО2 + 3К ® 2К2О без доступа кислорода
3. основной оксид
 *К2O + H2O 2КOH
*К2O + H2O 2КOH
 *К2O + СО2 К2СO3
*К2O + СО2 К2СO3
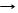 *K2O + 2HNO3 2KNO3 + Н2О
*K2O + 2HNO3 2KNO3 + Н2О
СУПЕРОКСИД КАЛИЯ КO2
1.2. *К + О2 ® КO2 супероксид калия
3. КО2 + 3К ® 2К2О оксид калия
2КО2 + 2H2O ® 2КОН + Н2О2 + O2
4КО2 + 2СО2 ® 2К2СО3 + 3O2
ГИДРОКСИД НАТРИЯ NaOH
1.2. 2NaCl + 2H2O электролиз ® 2NaОН + Cl2 + Н2
Na2CO3 + Ca(OH)2 ® 2NaOH + CaCO3¯
2.(н.у.)тв.кристал, гигроскопичный, растворим-щелочь
3.2. щелочь
*электролитическая диссоциация
NaOH ® Na+ + OH-
 *рН>7 цвет индикаторов лакмус + OH- фенолфталеин + OH- метилоранж + OH-
*рН>7 цвет индикаторов лакмус + OH- фенолфталеин + OH- метилоранж + OH-





* 
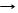 2NaOH + CO2 Na2CO3 + H2O затем Na2CO3 + CO2 + H2O 2NaHCO3
2NaOH + CO2 Na2CO3 + H2O затем Na2CO3 + CO2 + H2O 2NaHCO3
 2NaOH + Mn2O7 2NaMnO4 + H2O
2NaOH + Mn2O7 2NaMnO4 + H2O
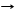 SO3 + NaOH NaHSO4
SO3 + NaOH NaHSO4
 SO3 + 2NaOH Na2SO4 + H2O
SO3 + 2NaOH Na2SO4 + H2O
 2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
2NO2 + 2NaOH NaNO3 + NaNO2 + H2O
 4NO2 + 4NaOH + О2 4NaNO3 + 2H2O
4NO2 + 4NaOH + О2 4NaNO3 + 2H2O
 2NaOH + SiO2 T Na2SiO3 + H2O растворение стекла
2NaOH + SiO2 T Na2SiO3 + H2O растворение стекла
реакции обмена(условия необратимости реакции..)
*NaOH + HCl ® NaCl + H2O реакция нейтрализации эквивалентных количеств кислоты H+ и основания OH-
*2NaOH + CuCl2 ® Cu(OH)2¯ + 2NaCl
реакции с амфотерными металлами-амфотерными оксидами-амфотерными гидроксидами
*  2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
 ZnO + 2NaOH + H2O Na2[Zn(OH)4] тетрагидроксицинкат натрия
ZnO + 2NaOH + H2O Na2[Zn(OH)4] тетрагидроксицинкат натрия
 ZnO + 2NaOH T Na2ZnO2 + H2O
ZnO + 2NaOH T Na2ZnO2 + H2O
 Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4] тетрагидроксиалюминат натрия
Al2O3 + 2NaOH + 3H2O 2Na[Al(OH)4] тетрагидроксиалюминат натрия
 Al2O3 + NaOH крист T 2NaAlO2 + H2O метаалюминат сплавление
Al2O3 + NaOH крист T 2NaAlO2 + H2O метаалюминат сплавление
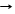 Zn(OH)2 + 2NaOH T Na2ZnO2 + 2H2O сплавление
Zn(OH)2 + 2NaOH T Na2ZnO2 + 2H2O сплавление
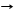 Zn(OH)2 + 2NaOH Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH Na2[Zn(OH)4]
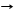 Al(OH)3 + NaOH Na[Al(OH)4]
Al(OH)3 + NaOH Na[Al(OH)4]
*ОВ реакции:
 2NaOH + Cl2 холод NaCl + NaOCl + H2O
2NaOH + Cl2 холод NaCl + NaOCl + H2O

 6NaOH + 3Cl2 T 5NaCl + NaClO3 + 3H2O
6NaOH + 3Cl2 T 5NaCl + NaClO3 + 3H2O
 2NaOH + Si + H2O T Na2SiO3 + 2H2
2NaOH + Si + H2O T Na2SiO3 + 2H2
 6NaOH + 3S T Na2SO3 + 2Na2S + 3H2O
6NaOH + 3S T Na2SO3 + 2Na2S + 3H2O
 3NaOH + 4P + 3H2O T 3NaH2PO2 + PH3
3NaOH + 4P + 3H2O T 3NaH2PO2 + PH3
ГИДРОКСИД КАЛИЯ КOH
.. *ОВ реакции:
 6KOH + 3Cl2 T 5KCl + 3H2O + KClO3 бертолетова соль
6KOH + 3Cl2 T 5KCl + 3H2O + KClO3 бертолетова соль
КАРБОНАТ НАТРИЯ Na2CO3
КАРБОНАТ КАЛИЯ К2CO3
 1.3. CO2 + H2O + NH3 (NH4)НCO3
1.3. CO2 + H2O + NH3 (NH4)НCO3
 (NH4)НCO3 + NaCl NH4Cl + NaHCO3¯
(NH4)НCO3 + NaCl NH4Cl + NaHCO3¯
выпадает в осадок из-за нерастворимости в охлажденном насыщенном растворе
 NaHCO3 T Na2CO3 + CO2 + H2O
NaHCO3 T Na2CO3 + CO2 + H2O
2. тв.кристал, ´растворимы Н2О(кроме солей щелочных металлов)
3. соли слабой кислоты
*электролитическая диссоциация
*реакции гидратации(образуются кристаллогидраты)
 Na2CO3 + 10H2O Na2CO3*10H2O
Na2CO3 + 10H2O Na2CO3*10H2O
*реакции гидролиза
2Na2CO3 + H2O Û NaOH + NaHCO3
*реакции обмена с кислотами-основаниями-солями(условия необратимости реакции..)
 Na2CO3 + 2HCl 2NaCl + H2O + CO2
Na2CO3 + 2HCl 2NaCl + H2O + CO2
 CO32- + 2H+ H2O + CO2 качественная реакция
CO32- + 2H+ H2O + CO2 качественная реакция
 Na2CO3 + Ca(ОН)2 CaCO3¯ + 2NaОН
Na2CO3 + Ca(ОН)2 CaCO3¯ + 2NaОН
 Na2CO3 + CaCl2 CaCO3¯ + 2NaCl
Na2CO3 + CaCl2 CaCO3¯ + 2NaCl
 CO32- + Ca2+ CaCO3¯ качественная реакция
CO32- + Ca2+ CaCO3¯ качественная реакция
*карбонаты K-Na-Ba термически стойкие
применение соединений натрия и калия, калийные удобрения
4. едкий натр NaOH очистка нефти и бензина
получение мыла и СМС
получение бумаги
хим.промышленность – получение фенола
в быту
пероксид натрия Na2O2 регенераторы O2
Na2CO3 кальцинированная сода, кристаллическая сода Na2CO3*10H2O ® стекло-мыло-лекарства
NaHCO3 питьевая сода
K2CO3 ® стекло, калийное удобрение
KClO3 бертолетова соль ® порох, спички
минеральные удобрения
*1840 Ю.Либих "теория минерального питания растений"
- для питания растений необходимы питательные в-ва, содержащие макро и микроэлементы
ПР: макроэлементы(C-O-H-N-P-K-S-Ca), микроэлементы(Fe-Mn-B-Cu-Zn-Mg-Co..)
- источник С есть СО2, источник Н-О есть Н2О, источник остальных элементов есть в-ва почвы
- растения используют питательные в-ва почвы в виде ионов: K+, NH4+… и NO3-, HPO4-…
- при недостатке питательных в-в у растений развиваются болезни
ПР: при недостатке N ® задержка роста, окрашивание бледно-зелёное или жёлтое
при недостатке P ® задержка развития цветков плодов
при недостатке K ® задержка накопления углеводов в плодах
- при недостатке питательных в-в нужно вносить в почву минеральные удобрения,
различают макроудобрения(содержат макроэлементы N-P-K..) и микроудобрения(содержат микроэлементы..),
различают удобрения простые(содержат 1 пит.элемент) и комплексные,
комплексные удобрения содержат 2-3 пит.элемента
ПР: сложное удобрение аммофос N H4H2 P O4 +(N H4)2Н P O4
калийные K Cl K NO3 K 2CO3
характеристика элементов главной подгруппы 2 группы
подгруппа магния Be Mg Ca Sr Ba Ra ЩЕЛОЧНО-ЗЕМЕЛЬНЫЕ
ПС IIА
| Be | металлы | тв.мягкие-легкоплавкие |
| Mg | ||
| Ca | ||
| Sr | ||
| Ba | ||
| Ra | металл радиоактивный |
с ростом величины порядкового номера в главной подгруппе металлические свойства
(физ.смысл) размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «Mg – Ba»,
строение внешней е-оболочки..s2, s-элементы ПР: +20Са 1s22s2р63s2р6d04s2 4s
 |
3s 3p 3d
 |  |  |  |  |  |  |  |  |
2s 2p
 |  |  |  |
1s
 |
Cа
+20
при возбуждении е- распариваются и переходят от s-орбитали на свободные р-орбитали,
возможна гибридизация,
атомы элементов IIА группы проявляют низкую электроотрицательность,
легко отдают валентные e-,
металлы элементов IIА группы – восстановители
ПР: Са 0 - 2e- ® Cа +2
«элементы главных подгрупп проявляют сходную степень окисления»
(физ.смысл) окисление – процесс отдачи е-, степень окисления - количество отданных е-,
элементы главных подгрупп отдают “s”-“р”e- внешнего эн.уровня,
имея общую структуру валентных е-, они проявляют сходную степень окисления,
ст.окисления и валентность магния 0 +2 (II)
кальция 0 +2 (II)
бария 0 +2 (II)
номер группы, как правило, равен max(+)степени окисления хим.элементов данной группы
ПР: IIА max(+)степень окисления +2
с ростом величины порядкового номера в главной подгруппе восстановительные свойства
(физ.смысл) размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «Be - Ba»
водородные соединения
| RH2 | ||
| BeH2 | тв. | восстановители |
| MgH2 | ||
| CaH2 | ||
| SrH2 | ||
| BaH2 | ||
водородные соединения щелочно-земельных металлов - соединения с ионной хим.связью,
с ростом порядкового номера в главной подгруппе восстановительные свойства водородных соединений
высшие оксиды
| RO | ||
| BeО | тв. | амфотерный ® амфотерный гидроксид |
| MgО | основной ® малорастворимое основание | |
| CaО | основные ® растворимые основания | |
| SrО | ||
| BaО | основной ® едкая щелочь | |
с ростом порядкового номера в главной подгруппе основные свойства высших оксидов
с ростом порядкового номера в главной подгруппе сила оснований высших оксидов
(физ.смысл) размеры центр.атома , его связь с группой НО- уменьшается, эл.диссоциация усиливается
ПР: Ca(OH)2 сильнее Mg(OH)2
по сравнению с щелочными металлами элементы IIА менее активные-более твердые-более плотные-с большей Тплав
соединения кальция в природе и их значение
кальций распространен в природе - 3,6% от массы земной коры
в природе щелочно-земельные металлы встречаются виде хим.соединений, в виде простых в-в не встречаются
ПР: СаСО3 известняк, мел, мрамор,
CaSO4*2H2O гипс
Ca3(PO4)2 фосфорит
CaCO3*MgCO3 доломит
физ.и хим.свойства кальция
КАЛЬЦИЙ Cа
1.3.  СаСl2 электролиз Са + Cl2(добавляют CaF2)
СаСl2 электролиз Са + Cl2(добавляют CaF2)
2.(н.у.) тв.мягкий-пластичный-с Ме блеском на срезе-легкоплавкий-легкий(rСа=1,55)
3. активный металл- восстановитель
 *2H2О + Са Ca(OH)2 + H2
*2H2О + Са Ca(OH)2 + H2
 *2HCl + Са СаCl2 + H2
*2HCl + Са СаCl2 + H2
 *O2 + Ca 2CaO
*O2 + Ca 2CaO
 Cl2 + Са СаCl2
Cl2 + Са СаCl2
 S + Са T СаS
S + Са T СаS
 N2 + 3Са T Са3N2
N2 + 3Са T Са3N2
 2P + 3Ca Т 2Ca3P2 фосфид кальция
2P + 3Ca Т 2Ca3P2 фосфид кальция
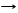 2C + Ca T CaC2 карбид кальция
2C + Ca T CaC2 карбид кальция
 Si + 2Са Т Са2Si
Si + 2Са Т Са2Si
 Н2 + Са T СаН2
Н2 + Са T СаН2
оксид кальция и гидроксид кальция: получение и свойства
ОКСИД КАЛЬЦИЯ СаО НЕГАШЕНАЯ ИЗВЕСТЬ
1.3. CaCO3 T ® СaO + CO2 обжиг известняка
2.(н.у.) тв.порошок, белый, TплавСаО=2570°C
3. основной оксид
*СаО + Н2О ® Са(ОН)2 + Q гашеная известь
*CO2 + CaO ® CaCO3
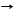 SO2 + CaO CaSO3
SO2 + CaO CaSO3
SO3 + CaO ® CaSO4
CaО + SiO2 T ® CaSiO3 сплавление
 *2HCl + CaO H2O + CaCl2
*2HCl + CaO H2O + CaCl2
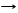 *2C + CaО T CaC2 + СО реакция диспропорционирования
*2C + CaО T CaC2 + СО реакция диспропорционирования
ГИДРОКСИД КАЛЬЦИЯ Са(ОН)2 ГАШЕНАЯ ИЗВЕСТЬ
1.3. СаО + Н2О ® Са(ОН)2 + Q
2.(н.у.) тв.порошок серый,
малорастворим Н2О(водный раствор есть известковая вода, водная суспензия есть известковое молоко)
3. сильное основание
*электролитическая диссоциация ступенчатая(2-кислотное основание)
Са(ОН)2 ® Са(ОН)+ + OH-
Са(ОН) Û Са2+ + OH-
*рН>7 цвет индикаторов лакмус + OH- фенолфталеин + OH- метилоранж + OH-






малиновый
 *Ca(OH)2 + CO2 CaCO3¯ + H2O помутнение известковой воды
*Ca(OH)2 + CO2 CaCO3¯ + H2O помутнение известковой воды
в избытке газа осадок растворяется CaCO3 + CO2 + H2O ®Ca(НCO3)2
при нагревании осветлённого раствора ® осадок Ca(НCO3)2 T ®CaCO3¯ + Н2О + СО2
 Cа(OH)2 + SO3 CаSO4 + H2O
Cа(OH)2 + SO3 CаSO4 + H2O
 Ca(OH)2 + SiO2 T СаSiO3 + H2O
Ca(OH)2 + SiO2 T СаSiO3 + H2O
реакции обмена(условия необратимости реакции..):
*2HCl + Са(ОН)2 ® СаCl2 + H2O реакция нейтрализации эквивалентных количеств кислоты H+ и основания OH-
*Fe2(SO4)3 + 3Са(ОН)2 ® 2Fe(OH)3¯ + 3CaSO4
CO32- + Са2+® СаCO3¯белый качественная реакция
*реакция разложения
 Ca(OH)2 T CaO + H2O
Ca(OH)2 T CaO + H2O
*ОВ реакции:
2 Са(ОН)2 + 2Cl2 ® Ca(ОCl)2 + CaCl2 + 2H2O
 Ca(OH)2 + Cl2 H2O + Ca(ОCl)Cl хлорная известь
Ca(OH)2 + Cl2 H2O + Ca(ОCl)Cl хлорная известь
4. Са(ОН)2 известь гашеная строительный раствор: вода + песок + цемент
где отвердение Са(ОН)2 + СО2 ® СаСО3¯ + Н2О
Ca(ClO)2 хлорная известь для отбеливания-дезинфекции,
где Ca(ClO)2 + Н2О + СО2 ® СаСО3¯ + 2НСlO хлорноватистая к-та НСlO ® НСl + О
CaSO4*2H2O гипс повязки при переломах, штукатурка в строительстве
жесткость воды, виды жесткости воды, способы устранения
различают жесткую и мягкую воду,
в жесткой воде плохо стирает мыло-плохо развариваются овощи-образуется накипь
ПР: Ca2+ + 2С17Н35COО-® (С17Н35COО)2Ca¯ мыло образует нерастворимые соединения
жесткость воды – свойства воды из-за высокого содержания солей, прежде всего Са Мg
 общая жесткость воды
общая жесткость воды
А) карбонатная или временная устраняется кипячением,
устраняется содой и известковым молоком
Са(HCO3)2 T ® CaCO3¯ + H2O + CO2
Мg(HCO3)2 T ® MgCO3¯ + H2O + CO2
 Са(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O где Ca2++ CO32-® CaCO3¯
Са(HCO3)2 + Ca(OH)2 ® 2CaCO3¯ + 2H2O где Ca2++ CO32-® CaCO3¯
Са(HCO3)2 + Na2CO3 ® CaCO3¯ + 2NaHCO3
Б) некарбонатная или постоянная не устраняется кипячением,
устраняется содой
СаSO4 + Na2CO3 ® CaCO3¯ + Na2SO4, где Ca2+ + CO32-® CaCO3¯
МgSO4 + Na2CO3 ® MgCO3¯ + Na2SO4, где Mg2+ + CO32-® MgCO3¯
используют ионообменные смолы
RNa2 + CaCl2 ® RCa + 2NaCl
RNa2 + Ca2+ ® RCa + 2Na+
жесткость определяется концентрацией и зарядом ионов в воде и измеряется в миллиэквивалентах ионов в 1 л воды:
 |
для ионов Ca2+
 |
для ионов Mg2+
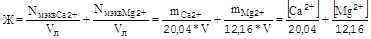 мг/л
мг/л
характеристика элементов главной подгруппы 3 группы, строение атома алюминия
Дата добавления: 2015-07-25; просмотров: 66 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Подгруппа натрия Li Na K Rb Cs Fr ЩЕЛОЧНЫЕ | | | Подгруппа алюминия B Al Ga In Ti |