
|
Читайте также: |
ПС VIIIВ 4s
 |
3s 3p 3d
 |  |  |  |  |  |  |  | ||||||||||
 | |||||||||||||||||
2s 2p
 |  |  |  |
1s
 |
Fe
+26
строение внешней е-оболочки..3d64s2, d-элемент,
Fe проявляет низкую электроотрицательность,
легко отдает валентные e-(4s-электроны и 3d-электроны),
металлы Fe – восстановитель
ПР: Fe 0 - 2e- ® Fe +2
Fe 0 - 3e- ® Fe +3
ст.окисления и валентность: железо 0 +2 +3 +6 (редко)(III) ПР:
железо более активный металл, чем кобальт и никель,
природные соединения железа
в природе элементы Fe встречается виде хим.соединений, очень редко в виде простого в-ва
ПР: Fe3O4 магнитный железняк
Fe2O3 красный железняк
FeS2 пирит
характеристика чугуна и стали
ЖЕЛЕЗО Fe
1.3. металлургия наука о промышленном получении металлов,
черная металлургия наука о промышленном получении железа,
широко используется не чистое железо, а его сплавы «чугун» и «сталь»,
чугун - сплав Fe и С(2-4%) с примесью S-P-Mn-Si
чугун твердый, но хрупкий-непластичный(металлоизделия получают литьем),
сталь - сплав Fe и С(0,2-2%) с примесью S-P-Mn-Si
сталь более пластичная(металлоизделия получаются ковкой-прокатом-..),
особые(легированные) стали получают добавлением Cr Mo W..,
выделяют А) получение из железной руды чугуна
Б) получение из чугуна стали
доменный способ получения чугуна
доменная печь хим.процессы:
1) сгорание кокса, образование CO
2) восстановление Fe2O3
3) удаление примесей SiO2 путем добавления CaCO3, шлак CaSiO3 всплывает над расплавленным металлом
4) образование примесей ПР: SiO2 + 2С Т ® Si + 2СО 3Fe + С Т ® Fe3C цементит
кислородноконвекторный способ получения стали ¹ низкие потребности в топливе
конвектор хим.процессы (¹ во всём объёме расплава):
1) окисление примесей путем вдувания O2
2) удаление примесей (оксиды P-S-Si) путем добавления CaCO3, шлак CaSiO3 Ca3(PO4)2всплывает
3) восстановление FeO раскислителями FeO + Mnферромарганец Т ® Fe + MnO MnO + SiO2 Т ® MnSiO3
мартеновский способ получения стали ¹ можно добавлять присадки для получения стали различных марок
мартеновская печь хим.процессы:
1) окисление примесей на поверхности.. в глубине..
2) удаление примесей (оксиды P-S-Si) путем добавления CaCO3, шлак CaSiO3 Ca3(PO4)2всплывает
3) восстановление FeO раскислителями FeO + Mnферромарганец Т ® Fe + MnO MnO + SiO2 Т ® MnSiO3
электродуговой способ получения стали ¹ получение тугоплавких сталей
электропечь: ванна, угольные электроды, электрическая дуга(выше 3000°С)
применение железа и его сплавов
4. металлоизделия
физ. и хим.свойства железа
2.(н.у.) тв.прочный-пластичный-е-проводник и теплопроводник-непрозрачный с Ме блеском,
тяжелый rFe=7,9, тугоплавкий 1500°С, имеет магнитные свойства
3. металл- восстановитель
*3Fe + 2O2 ® FeO*Fe2O3 железная окалина горение в кислороде
 3Cl2 + 2Fe T 2FeCl3
3Cl2 + 2Fe T 2FeCl3
 S + Fe T FeS
S + Fe T FeS
*4H2O + 3Fe раскаленное T ® FeO*Fe2O3 + 4H2
 5СО + Fe T Fe(CO)5 пентакарбонил железа
5СО + Fe T Fe(CO)5 пентакарбонил железа
*Fe + 2HCl ® FeCl2 + H2
Fe + H2SO4® FeSO4 + H2
Fe + 6H2SO4 конц T ® Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 4HNO3 T ® Fe(NO3)3 + NO + 2H2O
Fe + 6HNO3 конц T ® Fe(NO3)3 + 3NO2 + 3H2O
*Fe + CuSO4® FeSO4 + Cu¯
коррозия металлов разрушение металлов и сплавов под действия окружающей среды
А) химическое разрушение
Fe + 2H2O + O2 ® 2Fe(OH)2
4Fe(OH)2 + 2H2O + O2 ® 4Fe(OH)3
Fe + H2O + CO2 ® FeCO3 + H2
Fe + H2O + SO2 ® FeSO3 + H2
Б) электрохимическое разрушение..
физ. и хим.свойства оксидов железа
ОКСИД ЖЕЛЕЗА FeO
1.2. Fe2O3 + H2 T ® 2FeO + H2O
 СО + Fe3O4 600°С 3FeO + CO2
СО + Fe3O4 600°С 3FeO + CO2
Fe(OH)2 T ® FeO + H2O
2. тв.черный, нерастворимый
3. основной оксид, не реагирует с водой
FeO + 2HCl® FeCl2 + H2O
ОКСИД ЖЕЛЕЗА Fe2O3
1.2. 4FeS2 + 11O2 T ® 2Fe2O3 + 8SO2
4Fe + 3O2® 2Fe2O3
2. тв.бурый, нерастворимый
3. оксид амфотерный, не реагирует с водой, самое устойчивое соединение железа
*Fe2O3 + 6HCl® 2FeCl3 + 3H2O
*Fe2O3 + 2KOH® КFeO2¯ + Н2О
*Fe2O3 + Na2CO3® CO2 + 2NaFeO2 феррит натрия
*Fe2O3 + H2 T ® 2FeO + H2O
ОКСИД ЖЕЛЕЗА Fe3O4
2. Fe3O4 есть FeO*Fe2O3 железная окалина
е-проводник, имеет магнитные свойства
физ. и хим.свойства гидроксидов железа, зависимость свойств от степени окисления железа
ГИДРОКСИД ЖЕЛЕЗА Fe(OH)2
1.2. FeCl2 + 2KOH® Fe(OH)2¯ + 2KCl без доступа воздуха
2. тв.бледно-зеленый, нерастворимый
3. основание
*электролитическая диссоциация ступенчатая
Fe(OH)2Û Fe2+ + 2OH-
 *Fe(OH)2 + CO2 FeCO3 + H2O
*Fe(OH)2 + CO2 FeCO3 + H2O
 *Fe(OH)2 + 2HCl 2H2O + FeCl2 реакция нейтрализации
*Fe(OH)2 + 2HCl 2H2O + FeCl2 реакция нейтрализации
*реакция разложения
 Fe(OH)2 T FeO + H2O
Fe(OH)2 T FeO + H2O
*ОВ реакции восстановитель
4Fe(OH)2 + O2 + 2H2O® 4Fe(OH)3 легко окисляется в воде
ГИДРОКСИД ЖЕЛЕЗА Fe(OH)3
1.2. FeCl3 + 3KOH® Fe(OH)3¯ + 3KCl
2. тв.бурый, нерастворимый
состав Fe2O3*nH2O
3. амфотерный гидроксид
*электролитическая диссоциация..
Fe(OH)3Û Fe3+ + 3OH- или H3FeO3 + H2O Û H+ + [Fe(OH)4]-
 *Fe(OH)3 + 6HCl 3H2O + 2FeCl3 реакция нейтрализации
*Fe(OH)3 + 6HCl 3H2O + 2FeCl3 реакция нейтрализации
*Fe(OH)3 + 3KOH T ® К3[Fe(OH)6] гексагидроферрат(III) натрия
*реакция разложения
 2Fe(OH)3 T Fe2O3 + 3H2O
2Fe(OH)3 T Fe2O3 + 3H2O
соли железа (II) и (III)
соли Fe2+ тв.кристал.
3. соли слабого основания
*электролитическая диссоциация
гидролиз солей
*реакции замещения растворов солей с более активными металлами Zn
 FeSO4 + Zn ZnSO4 + Fe¯
FeSO4 + Zn ZnSO4 + Fe¯
*реакции обмена с кислотами-щелочами-солями(условия необратимости реакции..)
FeCl2 + 2KOH® Fe(OH)2¯ + 2KCl без доступа воздуха
3FeCl2 + 2K3[Fe(CN)6]® 6KCl + Fe3[Fe(CN)6]2¯синий качественная реакция на Fe2+
гексацианоферрат(III) калия гексацианоферрат(III) железа
красная кровяная соль турнбуллева синь
*ОВ реакции восстановители
5FeCl2 + 3KMnO4 + 4H2SO4® Fe2(SO4)3 + 3FeCl3 + KCl + MnSO4 + 4H2O
соли Fe3+ тв.кристал.
3. соли амфотерного основания
*электролитическая диссоциация
гидролиз солей
*реакции замещения растворов солей с более активными металлами Zn
*реакции обмена с кислотами-щелочами-солями(условия необратимости реакции..)
4FeCl3 + 3K4[Fe(CN)6]® 12KCl + Fe4[Fe(CN)6]3¯ синий качественная реакция на Fe3+
гексацианоферрат(II) калия гексацианоферрат(II) железа
желтая кровяная соль берлинская лазурь
*ОВ реакции слабые окислители
2FeCl3 + H2S® S + 2FeCl2 + 2HCl
2FeCl3 + 2KI® 2FeCl2 + I2 + 2KCl
положение неметаллов в периодической системе
среди простых в-в по физико-химическим свойствам различают металлы и неметаллы:
неметаллы – в-ва - газы или жидкости или тв.хрупкие-непластичные-плохо проводящие е-ток и тепло,
хим.элементы-неметаллы: He-Ne-Ar-Kr-Xe-Rn,F-Cl-Br-I-At,O-S-Se-Te,N-P-As,C-Si,B,H(22)
| I | II | III | IV | V | VI | VII | VIII | |
| [H] | B | C Si | N P As | O S Se Te | H F Cl Br I At | He Ne Ar Kr Xe Rn |
неметаллы расположены в конце периодов-в начале главных подгрупп(в правом верхнем углу таблицы ПС),
по е- строению неметаллы есть р-элементы(кроме водорода),
особенности е- строения неметаллов определяют их особые физические и химические свойства:
- у неметаллов внешний эн.уровень заполнен или практически заполнен e-,
размеры атомов неметаллов меньше, чем у металлов в том же периоде,
неметаллы проявляют высокую электроотрицательность,
неметаллы, как правило, окислители,
в хим.соединениях неметаллы образуют ковалентную связь(с металлами ионную связь)
с ростом величины порядкового номера в периоде неметаллические свойства
(физ.смысл) размеры атомов ¯, усиливается связь валентных е- с ядром атома, электроотрицательность
ПР: «В – F»
с ростом величины порядкового номера в главной подгруппе неметаллические свойства ¯
(физ.смысл) при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «F – I»
водородные соединения неметаллов - соединения с полярной ковалентной связью,
их водные растворы – слабые кислоты,
с ростом порядкового номера в главной подгруппе прочность водородных соединений ¯
(физ.смысл) размеры атомов , слабеет их связь с атомами водорода
с ростом порядкового номера в главной подгруппе кислотные свойства водородных соединений
(физ.смысл) размеры атомов , прочность водородных соединений уменьшается,
усиливается эл.диссоциация Н(неМе)®Н+ + неМе-
с ростом порядкового номера в главной подгруппе восстановительные свойства водородных соединений
(физ.смысл) размеры атомов , прочность водородных соединений уменьшается,
размеры атомов , слабеет связь валентных е- с ядром атома,
в итоге, при разрушении водородные соединения легче отдают электроны
 |  |
Н+ Н+
 |  | ||
неМе-
неМе- 
 |
с ростом порядкового номера в главной подгруппе сила кислородсодержащих кислот ¯
(физ.смысл) атомы О у центр.атома смещают е- плотность связи Н-О,
размеры центр.атома , уменьшается смещение е- плотности,
эл.диссоциация Н(неМеО)®Н+ + неМеО- уменьшается
 |  |
Н Н
 |  |
О H®O®ClO2 О H®O®BrO2
 |  | ||



 неМе+
неМе+
неМе+
О О О О
в природе неметаллы широко распространены
ПР: элементы земной коры
| кислород | 47% |
| кремний | |
| алюминий | |
| железо | 4,5 |
| кальций | |
| натрий | 2,5 |
| калий | 2,5 |
| водород | 0,8 |
двойственное положение водорода в периодической системе
степени окисления
ПС №1 1период VIIА – IA (водород помещают в VIIгруппу, а символ в Iгруппе заключают в скобки)
строение е-оболочки +1Н 1s1, s-элемент,
водород – восстановитель и окислитель,
H 0 + e- ® H +
H 0 - e- ® H -
ст.окисления и валентность 0 –1 +1 (I)
причина двойственного положения
- водород похож на щелочные металлы(s-элемент, является восстановителем)
- водород похож на галогены(неметалл, образует двухатомный газ, является окислителем)
водород ближе к галогенам, чем к щелочным металлам
изотопы
ядро атома состоит из нейтронов и протонов: протоны имеют положительный заряд, нейтроны не имеют заряда,
атомы характеризуются зарядом ядра(числом протонов) Z, числом нейтронов N, массовым числом A=Z+N,
изотопы – атомы одного хим.элемента с одним зарядом ядра и разным массовым числом
изотопы водорода протий 11Н w99,98% дейтерий 21Н w0,015% тритий 31Н w следы
распространение водорода в природе
водород распространен в природе - 0,8% от массы Земли(c=17%),
в природе водород чаще встречается в виде хим.соединений, в виде простого в-ва встречается редко
ПР: H2О вода распространенное на Земле в-во
природный газ-нефть-уголь
получение водорода в лаборатории и промышленности
ВОДОРОД H2
1.2.*реакции активных металлов с водой
 2Li + 2H2O 2LiOH + H2
2Li + 2H2O 2LiOH + H2
 2Na + 2H2O 2NaOH + H2
2Na + 2H2O 2NaOH + H2
 Ca + 2H2O Ca(OH)2 + H2
Ca + 2H2O Ca(OH)2 + H2
*реакции активных металлов с кислотами
 Zn + 2HCl ZnCl2 + H2
Zn + 2HCl ZnCl2 + H2
 Mg + 2HCl MgCl2 + H2
Mg + 2HCl MgCl2 + H2
*реакции алюминия и щелочей
 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
*реакции гидридов металлов с водой
 CaH2 + 2H2O Ca(OH)2 + 2H2
CaH2 + 2H2O Ca(OH)2 + 2H2
1.3.*C + H2O 1000°С Û СO + Н2 получение водяного газа(СО+H2+H2O), затем CО + H2O 450°С Û Fe2O3 СO2 + Н2
*CH4 + H2O 1000°С Û Ni СO + 3Н2 получение синтез-газа(СО+H2)
 *CH4 350°С Û Ni С + 2Н2
*CH4 350°С Û Ni С + 2Н2
*2NaCl + 2H2O электролиз Cl2 + H2 + 2NaOH
 *2H2O электролиз O2 + H2(в присутствии..)
*2H2O электролиз O2 + H2(в присутствии..)
*глубокое охлаждение(до -196°C) коксового газа(содержит до 60% водорода)
*крекинг нефти(побочный продукт)
физ. и хим.свойства водорода
2.(н.у.)газ без цвета–запаха-вкуса-самый легкий, ¯растворим H2O, TкипH2=-253°C
3. неметалл
окислитель
 *H2 + 2Na T 2NaH гидрид натрия
*H2 + 2Na T 2NaH гидрид натрия
 H2 + Са T СaH2
H2 + Са T СaH2
восстановитель
 *H2 + F2 2HF
*H2 + F2 2HF
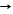 2H2 + O2 2H2O горение или взрыв, если смесь 2VН2/1VО2
2H2 + O2 2H2O горение или взрыв, если смесь 2VН2/1VО2
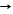 H2 + Cl2 hn 2HCl цепная реакция(радикальный механизм реакции)
H2 + Cl2 hn 2HCl цепная реакция(радикальный механизм реакции)
H2 + S T Û H2S очистка нефти от серы
3H2 + N2 T p Û Кt 2NH3
 *H2 + CuO T H2O + Cu
*H2 + CuO T H2O + Cu
 H2 + FeO T H2O + Fe
H2 + FeO T H2O + Fe
*2H2 + СO T р ® ZnO CH3OH метанол
*получение искусственного бензина
nСO + (2n+1)Н2 Т p ® Cr2O3 СnН2n+2 + nH2O
*С + 2Н2 400°С p ® Fe СН4
*гидрирование углеводородов
СHºСН + Н2 Т ® Ni СH2=СН2 этилен
СН2=СН2 + H2 Т ® Ni CН3-СН3 или 20°С Pt
 |  | ||
+ 3Н2 T ® Ni
циклогексан
восстановление альдегидов
Н-СОН + Н2 T ® Ni СН3ОН метанол
СН3-СОН + Н2 T ® Ni С2Н5ОН этанол
получение анилина из нитробензола
C6H5-NO2 + 3Н2 T ®C6H5-NН2 + 2Н2О
гидрирование жиров
СН2-О-СО-С17Н33 СН2-О-СО-С17Н35
| |
CН--O-CO-С17Н31 + 6Н2 T р ® Ni СН--О-СО-С17Н35
| |
СН2-О-СО-С17Н29 СН2-О-СО-С17Н35
применение водорода
4. получение аммиака NH3, соляной кислоты HCl, метанола СН3ОН,..
очистка нефти от серы
получение Mo-W путем восстановления из оксидов
инструмент "водородная горелка" для сварки-резания
топливо ракетного двигателя (H2 + O2)
гидрирование растительных жиров
строение молекулы воды
 3.1. H2O H -
3.1. H2O H -
\
О(II) -2 хим.связь одинарная полярная ковалентная, Ð105°
 / молекула имеет угловую форму _ -
/ молекула имеет угловую форму _ -
H -
молекула в виде диполя: 2 неподеленные е-пары атома кислорода образуют «-полюс» +
2 катиона водорода образуют «+полюс» + +
вода - в-во с особенными свойствами: растворяет многие в-ва(в-ва с полярными связями)
вызывает электролитическую диссоциацию,
имеет высокую Tкип°C Tплав°C,
имеет высокую теплоемкость,
особенные свойства воды определяются особенностями строения молекул воды:
- полярные молекулы воды у растворяемых в-в вызывают электролитическую диссоциацию – распад на ионы,
- между молекулами воды возникают водородные связи,
они определяют относительно высокую температуру кипения-высокую теплоемкость воды-max плотность при 4°С
роль молекул воды в процессе диссоциации веществ
полярные молекулы воды у растворяемых в-в вызывают электролитическую диссоциацию – распад на ионы,
растворяемые в-ва должны иметь ионные или полярные ковалентные связи,
вокруг частиц растворяемого в-ва молекулы воды образуют гидратные оболочки,
гидратные оболочки тормозят обратное слипание частиц растворяемого в-ва
ПР:  процесс диссоциации веществ(в-в с полярными связями) в воде
процесс диссоциации веществ(в-в с полярными связями) в воде
HCl полярная ковалентная связь
в-во находится в растворенном виде,
в электромагнитном поле диполя(H+Сl-) диполи(Н2О) располагаются упорядоченно,
взаимодействие диполей(Н+Cl-)и упорядоченно расположенных диполей(Н2О) ослабляет связи(Н+Cl-),
 образуются ионы Cl-_и Н+(свободно не существуют)
образуются ионы Cl-_и Н+(свободно не существуют)
физическая фаза ® химическая фаза:
в электромагнитном поле ионов Н+ и Сl- диполи (Н2О) располагаются упорядоченно
® гидраты ионов Сl- и ионы гидроксония Н3О+ (донорно-акцепторная связь)

NaCl ионная связь, ионная кристаллическая решётка
в электромагнитном поле ионов Na+ и Сl- диполи(Н2О) располагаются упорядоченно,
взаимодействие ионов Na+ и Cl- и диполей(Н2О) ослабляет связи(Na+Cl-),
образуются ионы Na+ и Cl-(одновременно идет растворение и диссоциация)
физическая фаза ® химическая фаза:
в электромагнитном поле ионов Na+ и Сl- диполи(Н2О) располагаются упорядоченно
® гидраты ионов Na+ и Сl-

NaОН ионная связь, ионная кристаллическая решётка
в электромагнитном поле ионов Na+ и ОН- диполи(Н2О) располагаются упорядоченно,
взаимодействие ионов Na+ и ОН- и диполей(Н2О) ослабляет связи(Na+ОН-),
образуются ионы Na+ и ОН-(одновременно идет растворение и диссоциация)
физическая фаза ® химическая фаза:
в электромагнитном поле ионов Na+ и ОН- диполи(Н2О) располагаются упорядоченно
® гидраты ионов Na+ и гидроксид-ионы ОН-
физ.свойства обычной и тяжелой воды
«обычная вода» образована атомами кислорода и атомами водорода в виде изотопа протия,
«тяжелая вода» образована атомами кислорода и атомами водорода в виде изотопа дейтерия,
2. (н.у.) жидкость без цвета-запаха-вкуса, rH2O=1000г/л (лёд ¯r) TкипH2O=100°C TплавH2O=0°C
особые свойства «тяжелой воды» rD2O=1105г/л TкипD2O=101,4°C TплавD2O=3,8°C
хим.свойства воды
3. по теории электролитической диссоциации амфотерное соединение (слабый электролит)
H2O Û OН- + Н+ без примеси солей-кислот-щелочей плохо проводит е-ток
*реакции с кислотами и аммиаком
 |  |  |  |
NH3 + H2O ® NH4+ + OH-
основание 1 кислота 1 кислота 2 основание 2
 |  |

 HCl + H2O ® H3О+ + Cl-
HCl + H2O ® H3О+ + Cl-
кислота 1 основание 1 кислота 2 основание 2
окислитель
 *2Na + 2H2O 2NaOH + H2
*2Na + 2H2O 2NaOH + H2
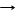 2H2O + 2Li 2LiOH + H2
2H2O + 2Li 2LiOH + H2
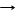 H2O + Zn T ZnO + H2
H2O + Zn T ZnO + H2
 4H2O + 3Fe T FeO*Fe2O3 + 4H2
4H2O + 3Fe T FeO*Fe2O3 + 4H2
 *CaH2 + 2H2O Ca(OH)2 + 2H2
*CaH2 + 2H2O Ca(OH)2 + 2H2
*C + H2O 1000°С Û СO + Н2 получение водяного газа(СО+H2+H2O)
*CH4 + 2H2O 1000°С Û Ni СO + 3Н2 получение синтез-газа(СО+H2)
*реакция разложения
 2H2О электролиз 2H2 + О2 (в присутствии солей-кислот-щелочей)
2H2О электролиз 2H2 + О2 (в присутствии солей-кислот-щелочей)
восстановитель
 *H2O + F2 HF + O O + F2 ® OF2 O + H2O ® H2O2 O + O2 ® O3 8F2 + 8H2O ® 14HF + OF2 + O2 + H2O2 + O3
*H2O + F2 HF + O O + F2 ® OF2 O + H2O ® H2O2 O + O2 ® O3 8F2 + 8H2O ® 14HF + OF2 + O2 + H2O2 + O3
*реакция разложения
 2H2О электролиз 2H2 + О2 (в присутствии солей-кислот-щелочей)
2H2О электролиз 2H2 + О2 (в присутствии солей-кислот-щелочей)
*реакция с хлором, бромом(с иодом не реагирует)
 Cl2 + H2O Û HCl + HClO затем HClO HCl + O дезинфекция-отбеливание
Cl2 + H2O Û HCl + HClO затем HClO HCl + O дезинфекция-отбеливание
Br2 + H2O Û HBr + HBrO
*реакции с оксидами(кроме SiO2)
 Li2O + H2O 2LiOH
Li2O + H2O 2LiOH
 CaO + H2O Ca(OH)2
CaO + H2O Ca(OH)2
 P2O5 + H2O 2HPO3 метафосфорная кислота
P2O5 + H2O 2HPO3 метафосфорная кислота
 P2O5 + 3H2O T 2H3PO4
P2O5 + 3H2O T 2H3PO4
 SO3 + H2O H2SO4
SO3 + H2O H2SO4
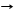 N2O5 + H2O 2HNO3
N2O5 + H2O 2HNO3
*образование гидратов
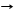 CuSO4 + 5H2O CuSO4*5H2O + Q
CuSO4 + 5H2O CuSO4*5H2O + Q
гидролиз
*реакции гидролиза солей
2Al2S3 + 6H2O ® 2Al(OH)3 + 3H2S
*реакции гидролиза карбидов
CaС2 + 2H2O ® Ca(OH)2 + С2H2
*реакции гидратации этиленовых
СН2=СН2 + H2O Т ® Н3РО4 CН3-СН2OН этанол
СН2=СН-CH3 + H2O Т ® Н3РО4 CН3-CH(ОН)-CH3
реакции гидратации ацетиленовых Кучеров
ОН О
/ //
НСºСН + Н2О Т ® Hg2+ H+ СН2=С нестойкий ® СН3-С
\ \
Н Н
виниловый спирт уксусный альдегид
СН3-СºСН + Н2О ® HgSO4 СН3-С=СН2 нестойкий ® СН3-С-СН3
| ||
OH O ацетон
*реакции гидролиза эфиров
СН3-СО-О-СН2-СН3 + Н2О Û СН3С-СООН + CН3-СН2OН
уксусная к-та этанол
реакции гидролиза жиров
СН2-О-СО-С17Н33 СН2-ОH С17Н33-СОOH
| |
CН--O-CO-С17Н31 + 3Н2O Kt ® СН-ОH + С17Н35-СОOH
| |
СН2-О-СО-С17Н29 СН2-ОH С17Н29-СОOH
реакция гидролиза крахмала
 (C6Н10О5)n + nH2O Т ® H2SO4 nC6Н12О6 глюкоза
(C6Н10О5)n + nH2O Т ® H2SO4 nC6Н12О6 глюкоза
(C6Н10О5)m
декстрины C12Н22О11
мальтоза
реакция гидролиза целлюлозы
(C6Н10О5)n + nH2O Т ® H2SO4 nC6Н12О6 глюкоза
реакции гидролиза белков
галогены, положение в периодической системе
электронное строение атомов, степени окисления и валентность элементов
объяснить их нечетные значения
Дата добавления: 2015-07-25; просмотров: 98 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Подгруппа алюминия B Al Ga In Ti | | | Подгруппа хлора F Cl Br I ГАЛОГЕНЫ |