
Читайте также:
|








2s 2p
 | |||||||
 |  |  | |||||
1s
 |
Р
+15
ПС №15 3период VА
строение е-оболочек +15P 1s22s2p63s2р3d0, р-элемент,
при возбуждении е- распариваются и переходят от s-орбитали на свободные d-орбитали,
фосфор – окислитель и восстановитель,
P 0 + 3e- ® P -3
P 0 - 3e- ® P +3
P 0 - 5e- ® P +5
ст.окисления и валентность 0 –3 +1 +3 +5 (III V)
ПР: Mg3P2 H3PO2 H3PO3 H3PO4
строение и физ.свойства аллотропных модификаций
фосфор белый тв. мягкий-белый–запах «чеснок»(ядовит), нерастворим H2O,
| растворим орг.растворителях, в темноте светится, TплавР=44°C, rР=1,8
Р (III) 0 хим.связь неполярная ковалентная
/ \ ¹ молекулярная крист.решётка Р4
образуется при осаждении паров фосфора
фосфор красный - смесь нескольких аллотропных модификаций
тв.порошок красный-без запаха, нерастворим H2O,
нерастворим орг.растворителях, в темноте не светится, TплавР=590°C(возгонка), rР=2,3
образуется из белого или черного фосфора при умеренном нагревании без О2
фосфор черный тв.черный-без запаха, нерастворим H2O,
| | нерастворим орг.растворителях, в темноте не светится, rР=2,7
P P (III) 0 хим.связь неполярная ковалентная
\ / \ / \ / ¹ атомная крист.решётка
P P P образуется из белого фосфора при нагревании под высоким давлением без О2
| | |
получение фосфора
ФОСФОР Р
 1.2. Ca3(PO4)2 + 5C + 2SiO2 T 3CaSiO3 + 5CO + 2P(пары Р4 белого фосфора собирают под водой)
1.2. Ca3(PO4)2 + 5C + 2SiO2 T 3CaSiO3 + 5CO + 2P(пары Р4 белого фосфора собирают под водой)
хим.свойства фосфора
3. неметалл (белый фосфор самый активный)
окислитель

 *2P + 3Ca T 2Ca3P2
*2P + 3Ca T 2Ca3P2
 2P + 3Mg T 2Mg3P2 фосфид магния
2P + 3Mg T 2Mg3P2 фосфид магния
 P + Al T AlP
P + Al T AlP
восстановитель (при недостатке окислителя у фосфора ст.окисления +3)
 *4Pбелый + 5O2 2P2O5 (или P4O10) самовоспламеняется или светится на воздухе
*4Pбелый + 5O2 2P2O5 (или P4O10) самовоспламеняется или светится на воздухе
 4Pкрасный + 5O2 T 2P2O5 (или P4O10) нач/нагревание 250°С
4Pкрасный + 5O2 T 2P2O5 (или P4O10) нач/нагревание 250°С
 4Pкрасный + 3O2 T 2P2O3
4Pкрасный + 3O2 T 2P2O3
 2P + 5Cl2 2PCl5
2P + 5Cl2 2PCl5
 2P + 3Br2 2PBr3
2P + 3Br2 2PBr3
 2P + 5S P2S5
2P + 5S P2S5
 2P + 3S P2S3
2P + 3S P2S3
 *5HNO3 + 3P + 2H2O 3H3PO4 + 5NO
*5HNO3 + 3P + 2H2O 3H3PO4 + 5NO
 5HNO3 конц + P H3PO4 + 5NO2 + H2O
5HNO3 конц + P H3PO4 + 5NO2 + H2O
 2Р + 5H2SO4 конц T 2H3РО4 + 5SO2 + 2H2O
2Р + 5H2SO4 конц T 2H3РО4 + 5SO2 + 2H2O
 *2Р + 5CuSO4 + 8H2O T 2H3РО4 + 5H2SO4 + 5Cu
*2Р + 5CuSO4 + 8H2O T 2H3РО4 + 5H2SO4 + 5Cu
реакция диспропорционирования
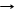 4Рбелый + 3NaOH + 3H2O T 3NaН2РО2 + PH3 фосфин
4Рбелый + 3NaOH + 3H2O T 3NaН2РО2 + PH3 фосфин
ОКСИД ФОСФОРА (III) P4O6 (обычно обозначают P2O3)
1.2. 4Р + 3О2недостаток ® Р4О6
2.(н.у.) тв.восковидная масса-белая(ядовита)
3. кислотный оксид
*P2O3 + 3Н2О ® 2Н3РО3(2-основная кислота)
*P2O3 + 4NaOH ® 2Na2[РО3Н] + Н2О
восстановитель
*P4O6 + 6Н2О ® РН3 + 3Н3РО4
*P4O6 + 6НCl ® 2PCl3 + 2Н3РО4
оксид фосфора(V)
ОКСИД ФОСФОРА (V) P4O10 (обычно обозначают Р2О5)
2.(н.у.) тв.кристал-белый-гигроскопичен (для хранения требуется герметизация упаковки)
3.1. P4O10 молекулярная кристаллическая решетка®
3. кислотный оксид
 *Р4О10 + 2Н2О 4НРО3
*Р4О10 + 2Н2О 4НРО3
 Р4О10 + 6Н2О T 4Н3РО4
Р4О10 + 6Н2О T 4Н3РО4
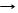 *P2O5 + 3BaO Ba3(РО4)2
*P2O5 + 3BaO Ba3(РО4)2
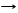 *P2O5 + 6NaOH 2Na3РО4 + 3Н2О
*P2O5 + 6NaOH 2Na3РО4 + 3Н2О
очень гигроскопичен
 *2НNO3 + Р2О5 2НРО3 + N2О5
*2НNO3 + Р2О5 2НРО3 + N2О5
 6НNO3 + Р2О5 2Н3РО4 + 3N2О5
6НNO3 + Р2О5 2Н3РО4 + 3N2О5
4. осушитель(очень гигроскопичен)
получение фосфорной кислоты
фосфорные кислоты
Н4Р2О7 дифосфорная кислота
H3PO4 ортофосфорная
H3PO3 фосфористая
H3PO2 фосфорноватистая
HPO3 метафосфорная
получение и свойства ортофосфорной кислоты
ОРТОФОСФОРНАЯ КИСЛОТА Н3РО4
 1.2. Р4О10 + 6Н2О T 4Н3РО4
1.2. Р4О10 + 6Н2О T 4Н3РО4
 Ca3(PO4) + 3H2SO4 T 3CaSO4¯ + 2Н3РО4
Ca3(PO4) + 3H2SO4 T 3CaSO4¯ + 2Н3РО4
 5HNO3 + 3P + 2H2O 3H3PO4 + 5NO
5HNO3 + 3P + 2H2O 3H3PO4 + 5NO
2.(н.у.) тв.кристал Tплав Н3РО4=42°C, растворима H2O
3. кислота
*электролитическая диссоциация ступенчатая(3-основная кислота)
Н3РО4 ® H+ + Н2РО4-
Н2РО4 Û H+ + НРО42-
НРО42-Û H+ + РО43-
*рН<7 цвет индикаторов лакмус + H+ фенолфталеин + H+ метилоранж + H+






реакции замещения с металлами до Н
 *2Н3РО4 + 3Mg Mg3(РО4)2 + 3H2
*2Н3РО4 + 3Mg Mg3(РО4)2 + 3H2
 2H+ + Mg Mg2+ + H2
2H+ + Mg Mg2+ + H2
реакции обмена с основными оксидами
 *2Н3РО4 + 3СаO 3H2O + Са3(РО4)2
*2Н3РО4 + 3СаO 3H2O + Са3(РО4)2
 2H+ + СаO Са2+ + H2O
2H+ + СаO Са2+ + H2O
реакции обмена с основаниями-солями(условия необратимости реакции..)
 *Н3РО4 + 3NaOH Na3РО4 + 3H2O реакция нейтрализация
*Н3РО4 + 3NaOH Na3РО4 + 3H2O реакция нейтрализация
H+ + OH-® H2O эквивалентные количества H+ и OH- нейтрализуют друг друга
 Н3РО4 + 2NH3 (NH4)2HРО4
Н3РО4 + 2NH3 (NH4)2HРО4
 Н3РО4 избыток + 2NaOH Na2HРО4 + 2H2O сильные кислоты вытесняют слабые из их солей
Н3РО4 избыток + 2NaOH Na2HРО4 + 2H2O сильные кислоты вытесняют слабые из их солей

 *3Na2CO3 + 2Н3РО4 2Na3РО4 + 3H2O + 3CO2 HNO3
*3Na2CO3 + 2Н3РО4 2Na3РО4 + 3H2O + 3CO2 HNO3
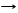 Cа3(PO4)2 + 4H3PO4 3Cа(Н2PO4)2 ряд к-т H2SO4,HCl,H2SO3,H2CO3,H2S,H2SiO3
Cа3(PO4)2 + 4H3PO4 3Cа(Н2PO4)2 ряд к-т H2SO4,HCl,H2SO3,H2CO3,H2S,H2SiO3
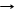 Н3РО4 + 3AgNO3 3HNO3 + Ag3РО4¯ H3PO4
Н3РО4 + 3AgNO3 3HNO3 + Ag3РО4¯ H3PO4
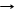 РО43- + 3Ag+ Ag3РО4¯ желтый качественная реакция
РО43- + 3Ag+ Ag3РО4¯ желтый качественная реакция
*реакции разложения
 2Н3РО4 T Н4Р2О7 + H2O дифосфорная кислота
2Н3РО4 T Н4Р2О7 + H2O дифосфорная кислота
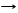 Н4Р2О7 T 2НРО3 + H2O метафосфорная кислота
Н4Р2О7 T 2НРО3 + H2O метафосфорная кислота
фосфаты, фосфорные удобрения
соли PO43- фосфаты - соли ортофосфорной кислоты ПР: Na3РО4 Mg3(РО4)2
минеральные удобрения
*1840 Ю.Либих "теория минерального питания растений"
- для питания растений необходимы питательные в-ва, содержащие макро и микроэлементы
ПР: макроэлементы(C-O-H-N-P-K-S-Ca), микроэлементы(Fe-Mn-B-Cu-Zn-Mg-Co..)
- источник С есть СО2, источник Н-О есть Н2О, источник остальных элементов есть в-ва почвы
- растения используют питательные в-ва почвы в виде ионов: K+, NH4+… и NO3-, HPO4-…
- при недостатке питательных в-в у растений развиваются болезни
ПР: при недостатке N ® задержка роста, окрашивание бледно-зелёное или жёлтое
при недостатке P ® задержка развития цветков плодов
при недостатке K ® задержка накопления углеводов в плодах
- при недостатке питательных в-в нужно вносить в почву минеральные удобрения,
различают макроудобрения(содержат макроэлементы N-P-K..) и микроудобрения(содержат микроэлементы..),
различают удобрения простые(содержат 1 пит.элемент) и комплексные,
комплексные удобрения содержат 2-3 пит.элемента
ПР: сложное удобрение аммофос N H4H2 P O4+(N H4)2Н P O4
фосфорные
Ca(H2 P O4)2*2H2O + CaSO4*2H2O простой суперфосфат
Ca3(PO4)2 + 2H2SO4 ® Ca(H2PO4)2 + 2CaSO4
Ca(H2 P O4)2*H2O двойной суперфосфат
Ca3(PO4)2 + 3H2SO4 ® 2H3PO4 + 3CaSO 4 (отделение ч/з_фильтрацию)
¯
4H3PO4 + Ca3(PO4)2 ® 3Ca(H2PO4)2
характеристика элементов подгруппы углерода
электронное строение атомов
подгруппа углерода C Si Ge Sn Pb
ПС IVА
| C | неметалл | тв. |
| Si | неметалл | |
| Ge | металл | |
| Sn | металл | |
| Pb | металл |
с ростом величины порядкового номера в главной подгруппе неметаллические свойства ¯
(физ.смысл) при увеличении количества энергетических уровней происходит рост размеров атомов,
размеры атомов , слабеет связь валентных е- с ядром атома, электроотрицательность ¯
ПР: «С - Рb»
строение внешней е-оболочки..s2р2, р-элементы
2s 2p
 | |||||||
 |  |  | |||||
1s
 |
C
Дата добавления: 2015-07-25; просмотров: 60 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| S 3p 3d | | | S 3p 3d |