
|
Читайте также: |
Измерение времен жизни возбужденных состояний в ряде фотолюминесцирующих объектов позволило выявить тип вторичного свечения, спектральные характеристики которого указывали на то, что это – флуоресценция, а величина времени жизни возбужденного состояния излучающих молекул – на то, что это триплетные возбуждения. Далее было показано, что вклад этого типа вторичного свечения в общую интенсивность флуоресценции нарастает по мере увеличения температуры образца. На основании этих данных было предположено, что подобный вид вторичного свечения связан с тем, что часть электронов с триплетного уровня Т1 (см. рис. 15) попадает не на основной синглетный уровень S0, а на возбужденную синглетную орбиталь S1, откуда и осуществляется излучательный переход. Иными словами, электронные переходы в молекуле люминофора при рассматриваемом типе фотолюминесценции могут быть описаны следующей схемой:
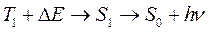
В этой схеме DЕ – величина энергии, которую должен затратить электрон при переходе с Т1 на S1, поскольку триплет-синглетный переход (интеркомбинационная конверсия) требует от электрона изменения спина, а в данном случае – еще и попадания на наиболее высокий колебательный подуровень орбитали Т1. Последнее обстоятельство объясняет тот факт, что вклад данного вторичного свечения в общую интенсивность флуоресценции образца возрастает с ростом температуры.
Рассмотренный тип фотолюминесценции носит название замедленная флуоресценция. Как и в случае фосфоресценции, интенсивность замедленной флуоресценции в обычных условиях (в жидких растворах и в присутствии кислорода) очень мала, поскольку большая часть триплетно-возбужденных молекул люминофора в такой ситуации инактивируется безизлучательно.
У большинства способных к фотолюминесценции соединений в замороженных растворах при низкой температуре (например, при 77о К) помимо флуоресценции выявляется более длинноволновая полоса вторичного свечения (рис. 24). Эта полоса связана с излучательным электронным переходом с триплетной орбитали Т1 на основной синглетный уровень S0 (рис. 15). Обусловленная таким переходом фотолюминесценция, как уже указывалось выше, носит название фосфоресценция. Её характерной особенностью является относительно медленное затухание после прекращения возбуждения молекул в объекте. В некоторых случаях регистрируемая фосфоресценция может сохраняться в течение нескольких секунд.
Поскольку переход Т1® S0 требует от электрона преодоления энергетического барьера, связанного с необходимостью изменения спина, строго говоря, он является запрещенным. Поэтому молекулы с электроном, находящимся на триплетном уровне, могут пребывать в возбужденном состоянии достаточно долго. Например, истинное время жизни триплетно-возбужденных молекул триптофана составляет около 4 секунд (для сравнения истинное время жизни синглетных возбуждений у этой аминокислоты – 10-9 секунды).
Из-за большого истинного времени жизни триплетных возбуждений с ростом температуры вероятность безизлучательного их тушения растет намного быстрее, чем у синглетных. Соответственно, квантовый выход фосфоресценции в обычных условиях очень мал. При 20-25оС лишь изредка в молекулах крупных белков можно зарегистрировать фосфоресценцию ароматических аминокислотных остатков в виде «плеча» на длинноволновом склоне полосы флуоресценции с помощью флуориметров обычного типа.
|
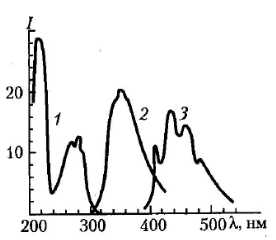
Рисунок 24. Спектры возбуждения фотолюминесценции (1), флуоресценции (2) и фосфоресценции (3) триптофана. J – регистрируемая интенсивность вторичного свечения.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 77.
Поскольку времена затухания вторичного свечения после прекращения генерации новых возбужденных состояний у флуоресценции и фосфоресценции сильно различаются, для измерения параметров фосфоресценции удобно применять специальные оптические приборы – фосфороскопы (рис. 25). Принцип работы этих устройств состоит в том, что фотолюминесценция образца в них регистрируется после перекрывания возбуждающего излучения.
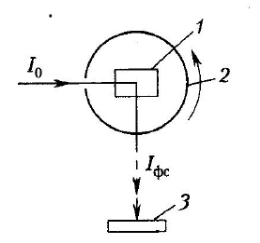
Рисунок 25. Схема устройства фосфороскопа. 1 – кювета с образцом; 2 – вращающийся цилиндр с прорезями; 3 – фотодетектор; J0 – возбуждающее излучение; Jфс – фосфоресценция образца.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 78.
Фосфороскоп позволяет регистрировать спектры фосфоресценции при комнатной температуре, несмотря на ее низкую интенсивность. Особенно значимы оказались измерения характеристик этого вида фотолюминесценции у мембранных белков, которые, как оказалось, являются весьма чувствительны к состоянию мембранных структур.
Поскольку в большинстве случаев реальное время жизни у триплетно-возбужденных молекул при низких температурах (порядка 77о К) достаточно велико, проводить измерение этого показателя значительно проще, чем в случае синглетного возбуждения: удается прямо регистрировать кинетики затухания фосфоресценции после прекращения возбуждения в режиме реального времени. Лишь в некоторых случаях приходится прибегать к специальным приемам. Например, при определении величины t у порфиринов (она составляет порядка 10-4 с) возбуждение молекул образца осуществлялось короткой вспышкой высокоинтенсивного излучения, а для регистрации затухания свечения применялись быстродействующие осциллографы. В таблице 3 приведены величины времен жизни фосфоресценции для некоторых белков при разной температуре.
Таблица 3. Времена жизни фосфоресценции ряда белков (в секундах) в буферном растворе при разной температуре.
Публикуется с модификациями по: Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: «Дрофа», 2006, с. 84.
| Температура, оС | Рибонуклеаза Т1 (фосфоресцируют остатки тирозина) | Лактатдегидрогеназа (фосфоресцируют остатки триптофана) | Щелочная фосфатаза (фосфоресцируют остатки триптофана) |
| 0,093 | 1,40 | 3,3 | |
| 0,050 | 0,97 | 2,61 | |
| 0,031 | 0,59 | 1,76 | |
| 0,025 | 0,29 | 1,22 | |
| - | 0,15 | 0,75 |
Обратите внимание на то, что измерения величины t для фосфоресценции этих протеинов осуществлялись при достаточно высоких температурах. Это оказалось возможным вследствие применения высокочувствительных фосфороскопов и благодаря тому, что ароматические аминокислотные остатки располагаются в этих белках внутри белковых глобул, где их подвижность и доступность для тушителей снижены.
Сопоставление величины t для триплетных возбуждений в разных белках позволило установить, что микровязкость окружения ароматических аминокислотных остатков внутри белковых глобул сильно (в пределах от 0,1 до 106 Па´с) варьирует. Оказалось также, что изменение конформации белковых молекул (например, вследствие связывания субстрата с активным центром у ферментов) весьма сильно сказывается на величине t фосфоресценции остатков ароматических аминокислот в их составе.
Следует заметить, что в живых клетках фосфоресценция ароматических аминокислотных остатков в цитоплазматических протеинах значительно ослаблена из-за наличия кислорода. Для кислорода триплетное состояние является основным, поэтому его молекулы очень эффективно тушат триплетно-возбужденные молекулы других веществ. Основной вклад в регистрируемую клеточную фосфоресценцию клеток вносят поэтому мембранные белки, доступ кислорода к ароматическим аминокислотным остаткам которых ограничен.
Дата добавления: 2015-07-25; просмотров: 411 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Поляризация фотолюминесценции. | | | Виды хемилюминесценции биологических систем. |