
Читайте также:
|
Как уже указывалось выше, в биологических объектах интенсивность фотолюминесценции различных люминофоров часто оказывается значительно слабее, чем у этих же люминофоров в той же концентрации в чистом виде. Помимо рассмотренных явлений экранировки возбуждающего света, реабсорбции фотолюминесценции и светорассеивания, обычных в биологических объектах, дополнительное ослабление вторичного свечения бывает связано с присутствием в этих объектах тушителей фотолюминесценции. Тушителем фотолюминесценции называются соединения, молекулы которых способны эффективно перехватывать энергию электронного возбуждения у возбужденных молекул-люминофоров. При этом формируются возбужденные молекулы вещества-тушителя, которые, однако, инактивируются преимущественно безизлучательно. В результате реальный квантовый выход фотолюминесценции изучаемого люминофора оказывается сниженным, и интенсивность его вторичного свечения падает.
Для количественного описания влияния тушителей напишем схему квантово-молекулярных событий, сопровождающих высвечивание кванта фотолюминесценции (Q – молекула тушителя):
| Событие | Электронный переход | Скорость протекания |
| Поглощение кванта | S0+hnп®S1 | v0=k0J0[S0] |
| Фотолюминесценция | S1® S0+ hnл | v1=k1[S1] |
| Внутримолекулярное тушение | S1®S0 | v2=k2[S1] |
| Тушение молекулой тушителя | S1+Q®S0+Q | v3=k3[S1][Q] |
В стационарном состоянии скорость генерации возбужденных молекул-люминофоров должна быть равна скорости их инактивации. Поскольку предполагается, что тушители не влияют на характер поглощения света исследуемым люминофором, скорость их генерации должна быть, таким образом, одинаковой как в присутствии тушителя, так и в его отсутствие. Следовательно, в стационарном состоянии и скорости инактивации возбужденных молекул люминофора в отсутствие и в присутствии тушителей должны совпадать. Таким образом, можно написать:
|
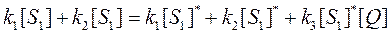
В выражении (80) [S1] и [S1]* - стационарные концентрации возбужденных молекул люминофора соответственно в присутствии и в отсутствие тушителя. Введем новую константу К, которая будет равна:

Теперь, используя эту константу, выразим в явном виде зависимость [S1]* от [S1] и [Q]. Получим:

|
 .
.
Поскольку интенсивность фотолюминесценции Jфл связана со скоростью инактивации возбужденных молекул люминофора через величину квантового выхода фотолюминесценции, а величины квантовых выходов фотолюминесценции будут в отсутствие (q)и в присутствии (q*) тушителя будут соответственно равны:
 ;
;
на основании выражения (81) легко показать, что отношение интенсивностей фотолюминесценции в отсутствие и в присутствии тушителя (Jфл и Jфл*) будет равно отношению стационарных концентраций возбужденных состояний молекул люминофора в соответствующих условиях:
|

Приведем выражение (82) к несколько иному, более удобному виду:
|

Выражение (83), показывающее зависимость интенсивности фотолюминесценции люминофора от концентрации тушителя в образце, носит название закона Штерна-Фольмера. Константа К в этом законе называется константой тушения. Величина этой константы – мера эффективности тушения фотолюминесценции данного люминофора данным тушителем в данных конкретных условиях. Для определения величины К в эксперименте строится зависимость отношения Jфл/Jфл* от концентрации тушителя ([Q]). Эта зависимость, если причиной ослабления вторичного свечения является истинное тушение фотолюминесценции, должна быть линейной, а тангенс угла ее наклона и есть искомая величина К.
К числу тушителей фотолюминесценции относится много веществ, достаточно распространенных в биологических объектах: тяжелые катионы и анионы (например, I-, Br-, Cs+, Cu2+), парамагнитные ионы и молекулы (O2, Mn2+), нитроксильные радикалы, гем. Кроме того, эффективно тушат фотолюминесценцию многие растворители, в т.ч. вода.
Последнее обстоятельство особенно сильно осложняет флуориметрические измерения, поскольку количественно оценить эффективность тушения фотолюминесценции растворителем сложно. Поэтому тушащий эффект растворителя оценивается косвенно, по изменению квантового выхода фотолюминесценции в данном растворителе в сравнении с другими. Поскольку растворитель всегда имеется в образце-растворе в достаточно большом количестве, его часто и не считают тушителем, обозначая так только другие имеющиеся в объекте растворенные молекулы. Вместе с тем, именно из-за тушения фотолюминесценции растворителями квантовые выходы вторичного свечения для многих молекул в растворах часто бывают не больше долей процентов. Надёжно зарегистрировать же фотолюминесценцию у вещества обычно возможно только при величине q³0,01. Соединения, у которых этот показатель в растворе оказывается ниже, принято считать не способными к фотолюминесценции, хотя на самом деле какое-то количество квантов вторичного свечения они испускают.
По механизму перехвата энергии электронного возбуждения у возбужденных молекул-люминофоров все тушители могут быть разделены на 2 группы.
При тушении фотолюминесценции динамического типа (тушении II рода) передача энергии электронного возбуждения с люминофора на тушитель осуществляется в ходе соударений этих молекул. При таком типе тушения по мере роста концентрации тушителя в системе величины q и t у молекул люминофора снижаются параллельно друг другу.
При статическом тушении (тушении I рода) растрата энергии электронного возбуждения происходит вследствие формирования устойчивого неспособного к фотолюминесценции комплекса тушителя с люминофором. Попробуем оценить такой вид тушения количественно. Пусть ЛФ – молекулы люминофора, Q - молекулы тушителя, НФ – неспособный к фотолюминесценции комплекс, формируемый из ЛФ и Q. Взаимодействие между люминофором и тушителем в таком случае может быть описано реакцией:

В равновесном состоянии должно выполнятся следующее условие:
|

где КД – константа диссоциации комплекса НФ.
Если предположить, что формирование комплекса не отражается на способности люминофора к поглощению возбуждающего излучения, из выражения (84) можно получить следующее:
|

В этом выражении q и q* - величины квантового выхода фотолюминесценции в присутствии и в отсутствие тушителя.
Уравнение (85) не будет выполняться, если поглощение возбуждающего света комплексом люминофор-тушитель будет отличаться от такового у чистого люминофора. Но при малых оптических плотностях системы в таких случаях можно написать:
|

где Jфл и Jфл* - соответственно интенсивности фотолюминесценции в отсутствие и в присутствии тушителя.
После преобразований выражения (86) его можно привести к виду:
|

Видно, что выражение (87) полностью соответствует по своей форме математическому выражению закона Штерна-Фольмера (уравнение (83) выше). Таким образом, путём исследования зависимостей интенсивности фотолюминесценции от концентрации тушителя в образце различить статическое и динамическое тушение невозможно. Однако, если имеется возможность измерения величины времени жизни возбужденных состояний в изучаемом объекте, то данная задача может быть решена. Дело в том, что величина t при статическом тушении не зависит от концентрации тушителя – падает только квантовый выход фотолюминесценции. В случае же динамического тушения, как уже отмечалось, с ростом содержания тушителя в образце квантовый выход свечения и реальное время жизни возбужденных состояний снижаются параллельно.
Один из видов статического тушения носит название концентрационное тушение. Ослабление фотолюминесценции вследствие этого вида тушения наблюдается при высоких концентрациях люминофора и связано с формированием в таких условиях димеров и более крупных молекулярных агрегатов люминесцирующих молекул, которые оказываются не способны к вторичному свечению.
Концентрационное тушение – весьма распространенное явление, которое используется в ряде случаев для изучения транспортных процессов в клетках и их органеллах. Например, краситель 9-аминоакридин интенсивно накапливается в клеточной цитоплазме и/или в митохондриях при условии, что цитоплазма клеток или внутримитохондриальное пространство имеют более низкое рН, чем среда инкубации. В ходе переноса красителя его концентрация внутри клеток или внутри органелл становится достаточной для развития концентрационного тушения фотолюминесценции. В результате появляется возможность измерять величину рН внутри клеток или их органелл по степени тушения фотолюминесценции данного красителя, который, таким образом, может рассматриваться как флуоресцентный зонд для измерения рН. Аналогично, цианиновые красители (например, diS-C3(5)), молекулы которых при нейтральных рН имеют положительный заряд, накапливаются в клетках и органеллах с отрицательно заряженной стороны мембран (т.е. обычно – внутри клеток и органелл). Степень этого накопления зависит от величины трансмембранной разности потенциалов. Соответственно, оценивая степень тушения фотолюминесценции этого красителя в суспензиях клеток или их органелл, можно оценить и величину трансмембранной разности потенциалов у исследуемого объекта. Это свойство позволяет использовать цианиновые красители в качестве флуоресцентных зондов на мембранный потенциал.
Дата добавления: 2015-07-25; просмотров: 93 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Влияние окружения люминесцирующих молекул на параметры фотолюминесценции. Флуоресцентные зонды и метки. | | | Миграция энергии электронного возбуждения |