
|
Читайте также: |
Нитриды косвенно получены для всех р-элементов IV группы, кроме свинца, но практическое значение имеет лишь нитрид кремния Si3N4 , он используется в создании коррозионно стойких и тугоплавких сплавов. Синтезируют его из ИПВ при 10000С.
Из углерода и азота при электрическом разряде образуется дициан (CN)2 (очень токсичный газ), а в присутствии H2 – цианид водорода HCN (жидкость при об.у., сильный неорганический яд). Их активность и химическая, и биологическая объясняется термодинамической нестойкостью (∆G0f равны соответственно 309 и 126 кДж/моль).
Водный раствор HCN называется циановодородной (синильной) кислотой (K d = 7 ⋅10−10 ). При об.у. она на 99,5% состоит из неядовитой формы:
H  N,
N,
а на 0,5% из ядовитой, содержащей, как и СО, углерод(II):
H 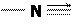 C (изоциановодородная кислота).
C (изоциановодородная кислота).
Эти формы находятся между собой в равновесии, причем при нагревании за счет увеличения миграции протона растет доля изокислоты. Она является восстановителем за счет C(II), поэтому противоядием может служить пероксид водорода:
HCN + H2O2 → N2 + CO2 + H2O.
Окисляется HCN также кислородом, причем в присутствии катализатора образуется смесь кислот циановой:
N 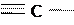 OH
OH
и изоциановой:
 H N CO.
H N CO.
(При 200С смесь содержит 98% изоформы (K d = 10−4 ), которая, судя по графическим формулам, получается окислением изоформы HCN, как более активной.)
Оба изомера относятся к производным угольной кислоты (в отличие от 3-го изомера, т.н. гремучей кислоты:
H 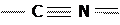 O).
O).
Соли циановодородной и циановой кислот образуются, например, при дисмутации дициана:
(CN)2 + NaOH → NaCN + NaCNO
(этим, как и многим другим, дициан похож на Г2 ).
Кипячением HCN с порошком серы получают тиоциановодородную
(родановодородную) кислоту (K d = 0,14). По ее формуле:
 H N C S
H N C S
видно, что сера тоже окисляет изоформу HCN. Соли (тиоцианаты) получают аналогично кислоте.
Тиоцианид водорода HCNS летуч, неограниченно растворим в воде, но при ω> 5% разлагается с образованием HCN и H2C2N2S3 . Легко окисляется перманганат-ионами.
Отметим, что отличительной особенностью цианид- и роданид-ионов является их способность выступать в качестве лигандов в комплексных соединениях (см. [8] и раздел «d-Элементы»).
Дата добавления: 2015-07-25; просмотров: 117 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Сульфиды | | | Нахождение в природе и получение простых веществ |