
Читайте также:
|
Оксиды азота. Все оксиды азота – эндотермические соединения, поэтому получают их с затратой энергии или косвенными методами.
Так, при пропускании электроразряда через газообразный воздух образуется NО (б/ц газ), а через сконденсированный – N2O3 , который даже в виде жидкости (голубого цвета, т.кип.=30С) распадается на газообразные NО (б/ц) и NO2 (бурого цвета).
Высший оксид N2O5 синтезируют дегидратацией азотной кислоты (с помощью
P2O5 ), причем с охлаждением, т.к. при об.у. б/ц кристаллы N2O5 (т.пл.=320С), отщепляя кислород, переходят в более устойчивый оксид NO2 . Последний образуется также окислением NО на воздухе[61]. (Эту реакцию используют при промышленном синтезе HNO.) 3
«Закись» азота N2O (б/ц газ) получается дегидратацией нитрата аммония при
2500С, т.е. процесс идет без изменения ст.ок., т.к. данный оксид является по существу оксид-нитридом азота(V):
N-3  N+5
N+5  O-2
O-2
Отметим, что оксиды азота в четных ст.ок. (NO и NO2) являются (как и в случае Г) радикалами. Поэтому они могут соединяться между собой, образуя промежуточный по ст.ок. оксид N2O3 . Или димеризоваться, давая соответственно N2O2 и N2O4 .
Последний димер, образованный за счет спаривания электронов, находящихся на несвязывающих МО [1], обладает значительно большей устойчивостью, чем N2O2 (образован при спаривании е разрыхляющих МО). Очевидно, N2O3 по устойчивости занимает среднее положение (при н.у. разлагается на исходные оксиды – см. выше).
Значения т.пл. и т.кип. оксидов N закономерно повышаются с увеличением атомности их молекул, причем в твердом состоянии N2O5 имеет решетку, которую можно представить, как построенную из ионов NO 2+ и NO3− , а N2O3 – из NO+ и NO. 2−
Наиболее устойчивые из оксидов азота: N2O, NО и NO2 , значительно различаются по окислительно-восстановительной кинетической активности. Так, NО (температура начала разложения выше 5000C; кратность связи 2,5) в отличие от других, не поддерживает горение серы, которая особенно энергично сгорает в N2O (кратность связи
1,5).
Зато восстановительная способность уменьшается в ряду: NO > NO2 > N2O. Так, NО легко окисляется хлором (до NOCl) и даже кислородом воздуха (см. выше), а NO2 лишь фтором (до NO2F) или озоном (до N2O5 ).
Благодаря способности выступать в роли и окислителя, и восстановителя, оксиды могут дисмутировать:
N2O ⎯⎯>700⎯⎯0 →NO + N2 2,
NO + NaOH → N2O + NaNO2 + H2O (медленно), NO2 + H2O → HNO3 + HNO2 .
Оксиды азота токсичны, существенна также их роль в образовании кислотных дождей. Поэтому существует проблема очистки от них выхлопных газов автомобилей и отходящих газов производств. Для этого предлагается, в частности, пропускать газы через насадки, содержащие, например, платиновый катализатор, который ускоряет разложение NO на N2 и O2 .
Однако известно и положительное действие этих веществ. Так, оксид NO2 применяют как катализатор доокисления не только SO2 до SO, 3 но и CO до CO2 ; а N2O
(«веселящий газ») используется в медицине для снятия стресса. Установлено и его обезболивающее действие, причем еще в 1799 г. ученым Х. Дэви, но лишь в 1844 г. его впервые применили для анестезии (при удалении зубов). Кроме того, выявлено, что нитроглицерин в организме, разлагаясь, выделяет NО, который регулирует тонус сосудов, а также обладает антираковым действием.
Оксиды аналогов азота. Для аналогов азота характерны оксиды состава Э2O3 и
Э2O5 (хотя получены неустойчивые РО и PO2 ). Подчеркнем, что если прочность соединений с водородом от азота к фосфору снижается (?), то с кислородом (а также со фтором) – растет (табл. 9) за счет стабилизации σ-связывания π(p − d) -перекрыванием и из-за увеличения разности Э.О. элементов (как и в VI группе при переходе от O к S).
Таблица 9. Энергии связей Э-О и Э-Н
| Связь | N − H | N−O | P − H | P−O |
| E связи, кДж/моль |
Подчеркнем, что оксиды фосфора и его аналогов, в отличие от оксидов азота, при об.у. все являются твердыми веществами. Это объясняется следующим. В соединениях азота чаще имеют место sp- и sp -2 гибридизации (как более обусловленные малым радиусом атома N), и потому устойчивы соединения с к.ч., равном 2 или 3.
В то же время для Р и его аналогов характерны sp -3 гибридизация и выше (из-за большего r и большей валентности). И для достижения значения к.ч.(Э), равного 4, происходит обобществление атомов кислорода соседними молекулами оксидов.
Поэтому решетка оксидов состава Э2O3 построена из димеров (Э4O6 [1]). А Bi2O3 вообще имеет координационную структуру, в которой к.ч.(Bi)=6 (sp3d2 -гибридизация) и к.ч.(О)=4 (sp -3 гибридизация).
В случае же оксидов в ст.ок. (+5) лишь активные модификации состоят из димеров Э4O10 [1], а менее активные имеют слоистую решетку, построенную из тетраэдров ЭO4 .
Соединения состава Э2O3 , а также P2O5 можно получить из ИПВ. Остальные оксиды Э2О5 из-за их нестойкости (?) синтезируют косвенными методами, например:
As2O3 + HNO3 (конц.) ⎯⎯ →−NO⎯ H3AsO4 ⎯⎯−H2⎯O → As2O5 .
P2O5
Даже при небольшом нагревании As2O5 выделяет кислород, образуя As2O3 , a Sb2O5 ⋅nH2O еще до полного высушивания переходит в Sb2O4 .
Оксид висмута(V) можно получить, воздействуя на Bi2O3 озоном, или по схеме:
Bi2O3 ⎯⎯Cl2+⎯NaOH⎯⎯→NaBiO3 ⎯⎯HNO⎯3 →Bi2O5 ⋅ nH2O.
Однако уже в момент образования продукт отщепляет кислород. В то же время P2O5 даже в парах присутствует в виде молекул P4O10 .
Получение гидроксидов. Оксиды азота(I) и (II) частично растворяются в воде (1 V N2O и 0,07 V NO в 1 V H2O), но химически с ней не реагируют, т.е. являются индифферентными. Хотя есть кислоты, соответствующие им по ст.ок.: азотноватистая (H2N2O2 ) и нитроксиловая (H4N2O4 ), содержащие связи: N = N и N − N соответственно.
Реагируют с водой оксиды состава Э2O3 и Э2O5 , где Э = N, P, As. Из них минимальную растворимость имеет «белый мышьяк» As2O3 (9 ⋅10−2 моль/л). В то же время взаимодействие с водой оксида фосфора(V) наиболее термодинамически обусловлено. Поэтому его используют как сильное осушающее средство (сравним: давление пара над P2O5 – 10−3 Па, а над H2SO4 (конц.) – 0,4 Па), а также для дегидратации кислот (см. выше) – даже H2SO4 переводит в SO. 3
Частично гидратируется и оксид сурьмы(V) с образованием малорастворимой кислоты H[Sb(OH) ]6 . Остальные оксиды с водой практически не взаимодействуют, и соответствующие гидроксиды получают реакциями обмена из солей. Гидролизом галидов можно синтезировать лишь кислотные гидроксиды, а в случае SbCl 3 и BiCl 3 процесс идет только до образования ЭОCl [7].
Отметим, что если на высший оксид азота действовать не H2O, а H2O2 , то можно получить надкислоту HNO4 .
Гидроксиды азота существуют, как правило, в виде мономеров, а для его аналогов (как и для аналогов О) при избытке оксида образуются полисоединения. Например, для фосфора получены метафосфорные кислоты, состоящие из циклов: (HPO3 )n (n=3, 4, 6), и полифосфорные, построенные из цепей: H3PO4 ⋅nHPO3 (n=1, 2, 3) [1]. Водой они медленно разлагаются до мономеров, быстрее при кипячении в присутствии HNO. 3
Промышленностью выпускаются 85%-ная H3PO4 и 58%-ная HNO. 3 Последнюю получают при насыщении воды диоксидом азота и кислородом под давлением 1 МПа по реакции:
NO2 + O2 + H2O → HNO3 .
Если в качестве исходного вещества брать димер N2O4 , а давление увеличить до 5 МПа, то образуется 98%-ная HNO, 3 которая используется при получении красителей.
Кислотно-основные свойства гидроксидов. Как и в других подгруппах рэлементов, оснóвные свойства гидроксидов сверху вниз увеличиваются, но снижаются при повышении ст.ок. элемента. Исключение составляют кислоты фосфора: H3PO4
(K1 = 7,5 ⋅10−3 ), H3PO3 (точнее: H2PHO3 , K1 = 10−2 ) и H3PO2 (т.е. HPH2O2 , K1 = 10−1 ), которые вследствие стремления P к 4-кратной координации и за счет достаточно устойчивой связи P − H (в отличие от As − H) имеют структуры:
 H OO HO H OO
H OO HO H OO
 ,,
,, 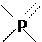 .
.
H OO H H O H HH
Таким образом, отношение n(O2−) /n(OH)− с понижением ст.ок. фосфора с (+5) до (+3) и до (+1) увеличивается с 1/3 до 1/2 и до 1, что и обусловливает усиление кислотных свойств.
Они усиливаются также с повышением степени полимеризации кислот фосфора (поскольку при этом тоже растет n(O2−) /n(OH)− ). Так, K1 (H4P2O7 ) = 1,4 ⋅10−1 ; а (HPO3 )6 по первой и второй ступеням диссоциирует как сравнительно сильная кислота и, лишь начиная с третьей ступени, как слабый электролит (K3 = 10−2 , K 4 = 10−3 и т.д.). Поэтому ее нормальные соли гидролизуются по аниону, подщелачивая раствор. Это используется на практике, например, гексаметафосфат натрия (Na6P6O18 ) применяют для умягчения жесткой воды.
Усиление оснóвных свойств в подгруппе проявляется в том, что если все оксиды и гидроксиды N, P, а также оксид As(V) при об.у. не взаимодействуют с кислотами, то остальные реагируют с концентрированной HCl:
As2O3 ⎫ ⎧H[AsCl4 ]
Sb2O3 ⎪⎪ ⎪⎪SbCl3
⎬ + HCl → H2O + ⎨
H[Sb(OH)6 ]⎪ ⎪[SbCl6 ]
Bi2O3 ⎪⎭ ⎪⎩BiCl3
Кроме того, лишь соединения висмута(III) не растворяются в щелочи, а висмутит NaBiO2 , полученный щелочным сплавлением, гидролизуется необратимо.
Устойчивость и окислительно-восстановительные свойства гидроксидов. Кислоты азота(III) и (V) неустойчивы, особенно HNO2 – существует лишь в водных растворах; проявляет за счет N(III) и окислительные, и восстановительные свойства, поэтому дисмутирует при об.у. с образованием NО и HNO. 3
Азотная кислота тоже разлагается (на NO2 , O2 и H2O), но медленно, быстрее в концентрированных растворах. Поэтому они желтого цвета – за счет наличия значительного количества NO2 . Установлено, что его присутствие обеспечивает окислительные свойства HNO, 3 в частности, при действии на металлы. При этом азот тем значительнее понижает ст.ок., чем активнее металл и чем разбавленнее кислота. Так, Zn восстанавливает HNO3 (конц.) преимущественно до N2O, а разбавленную – до NH, 4+ в то время как Cu до NO2 и NО, соответственно.
Не растворяются в концентрированной HNO 3 металлы, способные при ее действии образовывать плотную оксидную пленку (Cr, Al, Fe и др.), и благородные металлы (Au, Pt и др.). Однако последние реагируют с т.н. «царской водкой» (смесь концентрированных HNO 3 и НСl в молярном отношении 1:3). Ее повышенная «агрессивность» объясняется, во-первых, формированием устойчивых хлоридных комплексов данных М; а во-вторых, высокой окислительной активностью атомарного хлора, образующегося по реакции:
HNO3 + HCl → NOCl + H2O, NOCl → NO+"Cl".
В зависимости от концентрации азотная кислота по-разному реагирует и с органическими веществами: разбавленная – нитрует[62] их (реакция Коновалова), в то время, как концентрированная – окисляет (вплоть до CO2 и H2O). А смесь скипидара и HNO3 (конц.) [63] при добавлении H2SO4 (конц.) в качестве катализатора взрывается.
Редокс-активность кислот фосфора тоже определяется их устойчивостью, которая понижается с уменьшением ст.ок. фосфора. (Снижение стабилизации sp -[64] гибридизации π(р-d)-связыванием, невозможным с атомом водорода – см. графические формулы.) Поэтому гидроксиды фосфора(I) и (III) – сильные восстановители:
NiCl2 + HPH2O2 ⎫ 0
⎬ + H2O → M + H3PO4 + HCl. HgCl2 + H2PHO3 ⎭
Особенно неустойчив HPH2O2 (фосфиновая кислота) – дисмутирует до PH 3 и
H2PHO3 (фосфоновая кислота). Последняя тоже дисмутирует при нагревании, образуя
H3PO4 и PH. 3
Фосфорная кислота устойчива, поскольку E0 (H3PO4 /H3PO3) = −0,28 В и
E0 (H3PO4 /H3PO2 ) = −0,39 В. Как следствие того, что эти потенциалы достаточно отрицательны, в водных растворах фосфорная кислота способна окислять лишь за счет ионов водорода. (Рассчитайте значение E(H+ /H)2 в 1М H3PO4 сами, используя формулу
Нернста [3]).
При переходе от фосфора(V) к висмуту(V) устойчивость соединений снижается, а окислительная способность возрастает настолько, что висмутат-ионы в кислой среде переводят марганец(II) в перманганат-ионы (?).
Дата добавления: 2015-07-25; просмотров: 111 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Гидразин и гидроксиламин | | | Удобрения. Проблема связывания азота |