
Читайте также:
|
7.2.1. Общая характеристика. Нахождение в природе.
К s-элементам относятся щелочные (ЩМ) и щелочноземельные металлы (ЩЗМ), т.е. Э главных подгрупп I и II групп, имеющие конфигурацию s1 и s2 соответственно.
Поэтому ЩМ в соединениях проявляют только ст.ок.+1, а ЩЗМ –+2. И лишь в этих степенях окисления они находятся в природе в виде солей. Это галиды, сульфаты, нитраты, фосфаты, карбонаты, силикаты (например, тальк 3MgO.4SiO2.H2O или асбест CaO.3MgO.4SiO2), алюмосиликаты и др.
В частности, бериллий образует алюмосиликаты состава Be3Al2(SiO3)6, которые являются драгоценными камнями. (Из-за примесей они окрашены в разные цвета: зеленые изумруды, синие аквамарины, фиолетовые александриты и др.)
Больше всего на Земле (из Э данных групп) натрия (2,4%), кальция, магния (по 2%) и калия (1,4%) – они входят в восьмерку самых распространенных. Кларк других – 10-2 -10-3%, а цезия (10-8%), тем более Fr и Ra, значительно ниже.
Основным свойством s-элементов является минимальная прочность связи ядра с валентными е (среди Э каждого данного периода), особенно в случае ЩМ. Это объясняется тем, что при переходе к металлам 1А подгруппы (от соответствующего БЭ) начинается заполнение электронами нового уровня, поэтому атомный радиус резко возрастает. У ЩЗМ он немного меньше, чем у ЩМ (из-за более высокого заряда ядра), но все еще достаточно большой.
Как результат, s-элементы наиболее легко отдают электроны другим Э, а значит, образуют самые ионные соединения, и следовательно, наиболее растворимы в воде. Вот почему многие соли s-металлов входят в состав гидросферы.
Например, в морской воде – 0,38% хлорида магния, 2,5% хлорида натрия, а солей калия в 40 раз меньше. Зато в земле наоборот содержание K+ значительно больше, чем 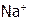 . Причина в том, что многие алюмосиликаты (в частности глина) прочнее удерживают в себе более крупные (по сравнению с
. Причина в том, что многие алюмосиликаты (в частности глина) прочнее удерживают в себе более крупные (по сравнению с 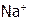 ) ионы калия, которые и накапливаются в почве при просачивании через нее природных вод. Благодаря этому К+ становится доступным растениям – им он нужен для плодоношения.
) ионы калия, которые и накапливаются в почве при просачивании через нее природных вод. Благодаря этому К+ становится доступным растениям – им он нужен для плодоношения.
В живых организмах больше ионов натрия (их массовая доля в крови человека составляет 0,6%, в мышцах – 1,5%), но и К+ необходим. Нужны организму также 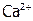 и
и 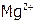 . Они находятся в крови и в костной ткани (80% массы которой составляет Са3(РО4)2). Напротив, Ве2+ и Ва2+ являются для организма ядами.
. Они находятся в крови и в костной ткани (80% массы которой составляет Са3(РО4)2). Напротив, Ве2+ и Ва2+ являются для организма ядами.
Дата добавления: 2015-07-25; просмотров: 132 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика | | | Жесткость воды и способы ее устранения |