
|
Читайте также: |
Угольная кислота слабая, очень неустойчива и даже в растворе отщепляет воду, переходя в газ СО2, поэтому его можно получит, действуя, например, раствором HCl на CaCО3.
Данная реакция является также качественной на карбонат-ионы. Их присутствие считают установленным, если при добавлении соляной кислоты к анализируемой пробе выделяются пузырьки газа (без запаха), которые проходя через «известковую воду» (насыщенный раствор Ca(ОН)2), вызывают ее помутнение:
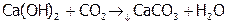 .
.
Если же пропускать СО2 через «известковую воду» достаточно долго, то осадок СаСО3 растворяется из-за перехода в кислую соль Са(НСО3)2. Эта реакция осуществляется под землей, где природная вода насыщена углекислым газом, а при выходе раствора на поверхность идет обратный процесс:
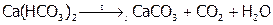 .
.
В промышленности СО2 получается как дополнительный продукт при термическом разложении известняка СаСО3.
6.5.4. Применение СО2 и проблемы его утилизации
Углекислый газ применяют достаточно широко. Для получения газированных напитков и в производстве соды; в качестве инертной среды; для организации безопасных взрывов и тушения пожаров (ибо в углекислом газе горят только такие активные металлы, как магний или алюминий). В атмосфере СО2 лучше сохраняются овощи, а при их выращивании в теплицах углекислый газ является хорошим газовым удобрением, и т.д. В виде же «сухого льда» СО2 используют для охлаждения продуктов и рассеивания туманов. С другой стороны, из-за интенсивного сжигания топлива в последние десятилетия содержание СО2 в атмосфере повышается (уже возросло с 0,03% до 0,06% в промышленных районах). Это, по мнению ряда ученых, приводит к потеплению климата, результатом чего может быть не только утрата части суши (из-за таяния вечных льдов) и учащение стихийных бедствий, но даже изменение суточного вращения Земли (последствия чего трудно даже предсказать). Так что существует проблема связывания СО2.
Ученые ищут способы, которые позволили бы превращать углекислый газ в ценные органические вещества, как это делают растения, благодаря наличию в них хлорофилла. (Круговорот С в природе показан на рисунок 9.) И одна из задач химии – создание катализаторов, подобных хлорофиллу, но достаточно дешевых.

Рис.9 Круговорот углерода в природе
Отметим, что есть водяные бактерии, которые превращают углекислый газ в сахар, а сахар – в нефть. Подсчитали, что таким образом 1 га водоема может дать больше топлива (а, значит, связать больше СО2), чем 1 га суши с самыми перспективными растениями. Так что может быть стоит заняться разведением этих микробов. А пока предлагается производственные отходящие газы, содержащие СО2, пропускать через раствор щелочи:
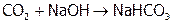 . (1)
. (1)
При этом СО2 поглощается достаточно полно, ибо равновесие (1) смещено вправо. И одновременно получается ценный продукт – питьевая сода.
Карбонаты и их применение. Соли угольной кислоты гораздо устойчивее к отщеплению СО2, чем сама кислота, и все выделены в свободном состоянии. Из средних солей хорошо растворимы лишь карбонаты ЩМ. Причем не только карбонаты, но и гидрокарбонаты ЩМ, гидролизуясь по аниону, создавают щелочную среду. Благодаря, в частности, этому, соли натрия и калия, выпускаемые содовым производством, находят широкое применение.
Например, питьевая сода (NaHCO3) используется в медицине (от изжоги). В еще больших масштабах применяется поташ К2СО3 и особенно (как более дешевый продукт) кальцинированная сода Na2CO3 (получается кальцинацией, т.е. прокаливанием, NaHCO3): в качестве стиральных порошков, для изготовления стекла, мыла и др. Поэтому содовое производство – одно из крупнейших в химической промышленности.
На практике широко используются и малорастворимые природные карбонаты кальция: известняк (для получения СаО и СО2 и в качестве строительного камня), мрамор (как облицовочная плитка), мел (для побелки) и др.
6.6. Кислородосодержащие соединения кремния.
Стекло. Цемент
Дата добавления: 2015-07-25; просмотров: 48 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика и свойства | | | Оксид. Гидроксид. Соли |