
Читайте также:
|
Азотная кислота по сравнению с азотистой, во-первых, сильнее, а во-вторых, более устойчива – даже выделена в свободном состоянии (это бесцветная жидкость с т. кип. 86°С). Однако она (и в виде водного раствора) разлагается при об.у. (хотя и медленно) на NO2, О2 и H2O.
Продукты взаимодействия HNO3 с металлами зависят как от концентрации кислоты, так и от активности М. Например, цинк восстанавливает разбавленную азотную кислоту до ионов аммония, концентрированную – до оксида азота (I), в то время как медь – лишь до оксида азота (II) и оксида азота (IV) соответственно.
Концентрированная азотная кислота, благодаря образованию при ее разложении атомарного кислорода, растворяет даже серебро (но не Au, Pt и т.п.), хотя пассивирует железо, алюминий и хром.
Кроме того, конц. HNO3 легко окисляет простые вещества многих неметаллов: графит до 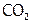 , фосфор до
, фосфор до  , серу до
, серу до  , иод до
, иод до  и др., восстанавливаясь при этом, как правило, до оксида азота (II). Реагирует она и с органическими веществами – основные продукты их полного окисления: СО2 и Н2О.
и др., восстанавливаясь при этом, как правило, до оксида азота (II). Реагирует она и с органическими веществами – основные продукты их полного окисления: СО2 и Н2О.
Очень концентрированная азотная кислота легко воспламеняет опилки и другие горючие материалы, поэтому используется как окислитель ракетного топлива.
Кроме того, азотная кислота применяется для приготовления лекарств, пластмасс, красителей, искусственных волокон и т.п., а также взрывчатых веществ (например, нитроглицерина, который является основой динамита).
Дата добавления: 2015-07-25; просмотров: 268 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Получение оксидов и кислот | | | Нитраты и нитриты |