
|
Читайте также: |
Вода и сероводород являются термодинамически стабильными соединениями (благодаря высокой устойчивости О и S в ст.ок. – 2), поэтому могут быть получены из исходных простых веществ.
В отличие от газообразного H2S, вода при об.у. – жидкость, несмотря на меньшую, чем у сероводорода, молекулярную массу. Это противоречие объясняется тем, что частицы H2S связаны между собой с помощью сравнительно слабых ММС, а молекулы 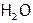 соединены прочными водородными связями. Причем в твердой воде (т.е. во льду) каждая частица
соединены прочными водородными связями. Причем в твердой воде (т.е. во льду) каждая частица 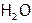 с соседними образует четыре Н-связи: две – двумя атомами Н и еще две – двумя электронными парами кислорода (на s- и на p-орбиталях).
с соседними образует четыре Н-связи: две – двумя атомами Н и еще две – двумя электронными парами кислорода (на s- и на p-орбиталях).
Отметим, что водородные связи длиннее, чем ХС, поэтому структура льда является ажурной (рыхлой), т.е. с большими пустотами. А при нагревании льда выше 00С часть Н-связей разрывается и отдельные молекулы Н2О входят в пустоты, в результате чего плотность воды растет (вплоть до 4°С). Вот почему она тяжелее льда. (Хотя под давлением 2 115 атм. получен настолько плотный лед, что он тонет в воде; а при 40 000 атм. образуется «горячий лед», плавящийся лишь при +175°С.)
Структура воды легко изменяется даже при слабых воздействиях, благодаря чему возможны различные методы «активации» воды (в частности, магнитом). И видимо, поэтому именно в воде зародилась жизнь (недаром все растительные и животные организмы на 50-99% состоят из Н2О).
Однако, если вода необходима для жизни, то сероводород является сильным ядом [16]. Поэтому при ощущении его запаха (тухлых яиц[17]) надо срочно проветрить помещение.
Вода – слабый окислитель ( ) и слабый восстановитель (
) и слабый восстановитель ( ). А сероводород (из-за большего радиуса S) как восстановитель гораздо сильнее (
). А сероводород (из-за большего радиуса S) как восстановитель гораздо сильнее (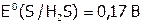 ) – легко окисляется даже иодом:
) – легко окисляется даже иодом:

а также серной кислотой (продукты S  и S) и кислородом воздуха (но медленно):
и S) и кислородом воздуха (но медленно):

Подчеркнем, что связи  длиннее, чем
длиннее, чем  , поэтому менее прочны и, значит, легче поляризуются до ионных с последующим отщеплением протонов. Вследствие чего раствор
, поэтому менее прочны и, значит, легче поляризуются до ионных с последующим отщеплением протонов. Вследствие чего раствор  в
в 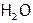 [18] является кислотой (сероводородной). Причем двухосновной, поэтому она образует и кислые соли (NaHS), и средние (
[18] является кислотой (сероводородной). Причем двухосновной, поэтому она образует и кислые соли (NaHS), и средние ( ). Из средних сульфидов растворимы лишь соли ЩМ и ЩЗМ.
). Из средних сульфидов растворимы лишь соли ЩМ и ЩЗМ.
Многие малорастворимые сульфиды имеют характерный цвет: ZnS – белый, MnS – розовый, CdS – желтый, HgS – красный, Sb2S5 – оранжевый, PbS – черный. Это используется для проведения качественных реакций на соответствующие катионы М, а также на сульфид-анион. В частности, влажная свинцовая бумага (т.е. пропитанная растворимой солью свинца) белого цвета является индикатором на сероводород, т.к. чернеет в присутствии даже небольших количеств H2S из-за образования PbS.
Дата добавления: 2015-07-25; просмотров: 92 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства и применение простых веществ | | | Перхалькогениды |