
|
Читайте также: |
Кислород в соединениях с водородом, кроме степени окисления –2 (в Н2О), может иметь и другие ее значения, в частности, –1 в 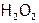 . Это вещество, как и вода, является жидкостью при об.у. Его графическая формула: Н–О–О–Н, т.е.
. Это вещество, как и вода, является жидкостью при об.у. Его графическая формула: Н–О–О–Н, т.е. 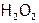 имеет гомоядерную связь О–О; поэтому называется пероксидом водорода[19].
имеет гомоядерную связь О–О; поэтому называется пероксидом водорода[19].
Данное соединение в свободном состоянии неустойчиво: при нагревании взрывается (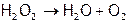 ). Благодаря способности отщеплять атомарный кислород (даже при об.у.) пероксид водорода легко воспламеняет опилки и т.п. (поэтому применяется как окислитель ракетного топлива).
). Благодаря способности отщеплять атомарный кислород (даже при об.у.) пероксид водорода легко воспламеняет опилки и т.п. (поэтому применяется как окислитель ракетного топлива).
При разбавлении водой устойчивость 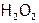 повышается, но даже 3%-й раствор пероксида водорода – сильный окислитель, поэтому используется для отбеливания волос, х/б тканей, для обеззараживания сточных жидкостей и т.д.
повышается, но даже 3%-й раствор пероксида водорода – сильный окислитель, поэтому используется для отбеливания волос, х/б тканей, для обеззараживания сточных жидкостей и т.д.
Получают 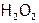 из пероксида бария по реакции:
из пероксида бария по реакции:
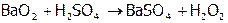 .
.
А 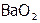 синтезируют, сжигая барий на воздухе. При сгорании натрия тоже образуется пероксид (
синтезируют, сжигая барий на воздухе. При сгорании натрия тоже образуется пероксид (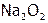 ). Он используется в противогазах пожарников и на космических кораблях для «освежения» воздуха, т.к. превращает СО2 в О2:
). Он используется в противогазах пожарников и на космических кораблях для «освежения» воздуха, т.к. превращает СО2 в О2:
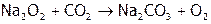 .
.
Поскольку атомы S более, чем O, склонны формировать гомоядерные σ-связи, то персульфиды устойчивее пероксидов. Например, персульфид железа(II) стабилен настолько, что встречается в природе – в виде минерала пирита. Из него обжигом (т.е. прокаливанием в присутствии кислорода воздуха) получают в промышленности оксид серы(IV):
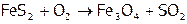 . (Этот процесс – первая стадия производства серной кислоты.)
. (Этот процесс – первая стадия производства серной кислоты.)
Дата добавления: 2015-07-25; просмотров: 61 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Вода и сероводород. Сульфиды | | | Кислородосодержащие соединения серы |