
Читайте также:
|
Азот (в отличие от кислорода) не имеет аллотропных форм, ибо слишком прочна тройная связь в N2. Из-за жесткости этой связи частицы N2 слабо поляризуются. Как следствие:
– незначительна растворимость азота (как и Н2) и в неполярных жидкостях, и в воде (около 15 мл N2 в 1 л Н2О при об.у., что в 2 раза меньше чем в случае О2);
– очень низки его т.пл. (–2100С) и т.кип. (–1960С), поэтому N2 широко используется в качестве эффективного и дешевого охладителя;
– азот не имеет цвета, запаха, вкуса, и в других отношениях биологически достаточно пассивен.
Это отражено и в его названии, которое несет смысл: «не поддерживающий жизни»[21]. (Ибо при исследовании свойств азота выяснилось, что в его атмосфере животные быстро погибают.)
В отличие от азота, фосфор, каждый атом которого образует по три 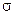 -связи с соседними, имеет больше вариантов их объединения между собой, поэтому дает несколько аллотропных форм. Из них на практике чаще всего используются т.н. белый фосфор и красный (рисунок 3).
-связи с соседними, имеет больше вариантов их объединения между собой, поэтому дает несколько аллотропных форм. Из них на практике чаще всего используются т.н. белый фосфор и красный (рисунок 3).
 |
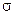 -связях у каждого атома.
-связях у каждого атома.
Однако в тетраэдрах p-орбитали расположены друг к другу под углом 600, что значительно отличается от естественного угла между ними (900). Поэтому связи напряжены и со временем одна из них в каждой молекуле разрывается.
Благодаря появляющимся при этом неспаренным электронам (на p-орбиталях) тетраэдры связываются друг с другом. (Теперь они уже искажены, ибо в них углы между p-орбиталями гораздо ближе к 900, а значит, состояние фосфора становится более устойчивым.) Так получаются цепи Рn (из искаженных тетраэдров – см. рис. 3б), т.е. формируется волокнистая структура – это красный фосфор (порошок фиолетово-кирпичного цвета).
По описанному механизму Р4 при хранении без доступа воздуха при об.у. медленно переходит в Рn, быстрее при нагревании (но не выше 2400С). Обратный переход (красного фосфора в белый) осуществляется выше 2400С, но тоже в отсутствии О2.
Частицы Рn значительно превосходят молекулы Р4 по числу атомов, и как следствие по величине Мr. Потому и свойства этих аллотропных форм резко различаются. Так, белый фосфор (в отличие от красного) летуч, имеет запах (чесночный), растворим в неполярных жидкостях. Его т.пл. (44,80С) намного ниже, чем у красного (6000С). И если Рn биологически достаточно пассивен, то Р4 – ядовит, а также вызывает долго не заживающие ожоги при попадании на кожу.
Дата добавления: 2015-07-25; просмотров: 55 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общая характеристика. Нахождение в природе. Получение | | | Химические свойства |