
Читайте также:
|
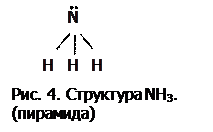 Аммиак NH3 (рисунок 4) – это нитрид водорода, т.е. вещество, в котором ст.ок. азота равна –3. Является экзосоединением и, значит, реакция:
Аммиак NH3 (рисунок 4) – это нитрид водорода, т.е. вещество, в котором ст.ок. азота равна –3. Является экзосоединением и, значит, реакция:
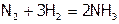
идет с выделением тепла (46,2 кДж/моль). Следовательно, как и при окислении SO2 до SO3, увеличение температуры должно снижать выход продукта, но в промышленности вынуждены повышать Т до 4000C (несмотря на присутствие катализатора), чтобы скорость процесса была достаточно высокой.
Кроме того, для большего выхода NH3 увеличивают давление до 200-1000 атмосфер, поскольку реакция идет с уменьшением объема. Но даже в этих жестких условиях выход аммиака не более 30%.
Правда, его легко отделить от непрореагировавших исходных веществ (азота и водорода), т.к. NH3 имеет сравнительно высокую т.кип. (–33,4°С) благодаря действию между его молекулами Н-связей. А под большим давлением, которое создается в системе при синтезе аммиака, он сжижается даже при комнатной температуре. (Остающиеся при этом газы N2 и H2 возвращаются обратно в колонну синтеза NH3.)
До сих пор ведутся работы по улучшению катализатора (например, добавлением к нему т.н. активаторов), чтобы снизить температуру процесса и т.о. повысить выход аммиака. Его мировое производство составляет несколько десятков миллионов тонн в год. Поэтому даже небольшое увеличение выхода NH3 оборачивается большим сокращением затрат на его получение. Испытаны уже тысячи веществ, но пока катализаторы, созданные человеком, далеки по эффективности от биологического, который работает в азобактериях и связывает азот воздуха при обычных условиях.
Подчеркнем, что в отличие от аммиака, соединения фосфора с водородом, из-за большего радиуса атома и невысокой электроотрицательности P (равной 2,1, а у N – 3) значительно менее устойчивы и самовоспламеняются на воздухе.
Дата добавления: 2015-07-25; просмотров: 59 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства | | | Физические и химические свойства |