
Читайте также:
|
Аммиак представляет собой бесцветный газ и со столь резким запахом, что вдыхание его приводит людей, потерявших сознание, в чувство.
Растворимость аммиака в воде максимальна среди известных газов (в 1л – 700 л при 20°С). Это объясняется полярностью частиц NH3 (рисунок 4) и их способностью к образованию Н-связей с молекулами растворителя. Кроме того, имеющаяся у атома азота НЭП (на рисунке 4 она изображена жирными точками) слабее удерживается ядром N, чем НЭП ядром О в молекуле воды (из-за большего r азота и меньшего заряда его ядра). Как следствие, эта электронная пара легче предоставляется на донорно-акцепторную связь с протоном[22] воды. В результате чего образуются устойчивые гидраты аммиака, например, NH3 . H2O (точнее: Н3N . HOН), что значительно повышает растворимость NH3. К тому же, часть молекул гидрата аммиака (примерно 4 из 1000) в водном растворе NH3 находится в диссоциированном состоянии:
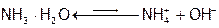 , Кd=1,8 10-5.
, Кd=1,8 10-5.
При диссоциации протон Н2О передается молекуле NH3 полностью, а оставшийся от воды ОН–-ион создает щелочную среду. Но поскольку гидрат аммиака является слабым электролитом, то создает не сильно щелочную среду: рН около 11. (А раствор гидроксида натрия может иметь pH>14.)
Из-за стремления N в наиболее устойчивую нулевую ст.ок. аммиак проявляет себя как восстановитель. Например, по отношению к оксидам металлов:
 .
.
Еще легче аммиак (тоже переходя в N2) восстанавливает Г2 (до Г–) и Н2О2 (до Н2О).
Дата добавления: 2015-07-25; просмотров: 42 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Получение аммиака | | | Соли аммония |