
|
Читайте также: |
Из множества кислородосодержащих соединений углерода мы рассмотрим лишь СО (угарный газ, т.е. оксид углерода(II)), СО2 (углекислый газ или оксид углерода(IV)), угольную кислоту и ее соли.
Молекулу угарного газа С формирует в s2p2-состоянии. При образовании же СО2 атом углерода возбуждается, приобретая sp3-конфигурацию, т.е. имеет 4 неспаренных электрона на 4-х орбиталях. Две из них (s- и px-) дают две 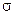 -связи с двумя О, а две другие (py- и рz-) формируют два
-связи с двумя О, а две другие (py- и рz-) формируют два  -перекрывания с р-орбиталями атомов кислорода. Но т.к. гибридизации подвергаются лишь орбитали, участвующие в
-перекрывания с р-орбиталями атомов кислорода. Но т.к. гибридизации подвергаются лишь орбитали, участвующие в 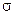 -связях, то имеем sp-гибридизацию, а значит, молекула СО2 линейна (рисунок 7) и потому (несмотря на полярность ХС в данной частице) она неполярна.
-связях, то имеем sp-гибридизацию, а значит, молекула СО2 линейна (рисунок 7) и потому (несмотря на полярность ХС в данной частице) она неполярна.
Тем не менее растворим в воде гораздо лучше углекислый газ (1 л в 1 л при 15°С), чем угарный (0,03 л в 1 л), хотя частица СО полярна. Бóльшая растворимость СО2 объясняется тем, что его молекулы (в отличие от СО) при обычных условиях химически соединяются с водой, образуя угольную кислоту (отсюда название СО2 – «углекислый газ»). Однако СО (в отличие от СО2) при нагревании реагирует с водой по типу ОВР, проявляя восстановительные свойства:
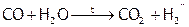 .
.
Оксид углерода (II) восстанавливает также М из их оксидов (что используется в металлургии):
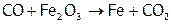 .
.
Дата добавления: 2015-07-25; просмотров: 48 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химические свойства простых веществ | | | Синтез и обнаружение диоксида углерода |