
Читайте также:
|
Наличие ионов s-М в природной воде часто создает неудобства при ее использовании. Так, соли кальция и магния делают воду жесткой, причем содержание от 2 до 6 ммоль/л  (где
(где  – это
– это 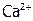 или
или 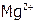 ) считается средней жесткостью.
) считается средней жесткостью.
В жесткой воде плохо развариваются продукты (мясо, овощи, крупы), появляется накипь на посуде (которая ускоряет ее износ и затрудняет нагрев содержимого посуды), при стирке ионы кальция и магния образуют с мылом осадки МА2 (буквой А обозначен однозарядный органический анион), поэтому на тканях остается налет, который их разрушает.
Отметим, что синтетические моющие средства (стиральные порошки), образующие растворимые соли кальция и магния, стирают хорошо и в жесткой воде.
Различают жесткость временную (то есть карбонатную) и постоянную (некарбонатную, а именно: хлоридно-сульфатную). Первая обусловлена гидрокарбонатами и легко устраняется кипячением или добавлением гашеной извести:
 ,
,
 .
.
Для ликвидации постоянной жесткости эти методы не годятся, а требуются более дорогие, например, применение соды:

В технике воду часто умягчают с помощью катионитов обычно в Na-форме. Они могут обменивать свои ионы (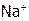 ) на ионы раствора
) на ионы раствора  :
:
 ,
,
здесь R – однозарядные анионы, связанные ковалентной ХС с полимерным каркасом катионита. Катионитом (в виде мелких гранул) заполняют, например, насадки на бытовые краны, предназначенные для очистки и умягчения водопроводной воды. После использования его регенерируют, т.е. переводят снова в Na-форму, обрабатывая насыщенным раствором хлорида натрия.
Дата добавления: 2015-07-25; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| S-Металлы и их соединения | | | Получение и свойства s-металлов |