
Читайте также:
|
А) В пробирку налейте 1 – 2 мл раствора перманганата калия и добавьте 5 – 6 капель раствора серной кислоты. В подкисленный раствор внесите небольшое количество кристаллической соли сульфита натрия. Что наблюдаете?
Напишите уравнения химических реакций. Коэффициенты в окислительно-восстановительной реакции подберите методом ионно-электронного баланса. К какому типу относится данная окислительно-восстановительная реакция?
Б) В пробирку налейте 1 – 2 мл раствора перманганата калия и добавьте 5 – 6 капель дистиллированной воды. В раствор внесите небольшое количество кристаллической соли сульфита натрия. Что наблюдаете?
Напишите уравнения химических реакций. Коэффициенты в окислительно-восстановительной реакции подберите методом ионно-электронного баланса.
В) В пробирку налейте 1 – 2 мл раствора перманганата калия и добавьте 5 – 6 капель концентрированного раствора гидроксида калия. В раствор внесите небольшое количество кристаллической соли сульфита натрия. Что наблюдаете?
Напишите уравнения химических реакций. Коэффициенты в окислительно-восстановительной реакции подберите методом ионно-электронного баланса. Как изменится состав продуктов реакции, если вместо гидроксида калия в опыте использовать гидроксид натрия? Составьте соответствующее уравнение химической реакции. Коэффициенты подберите методом ионно-электронного баланса.
Сделайте вывод о роли среды при протекании окислительно-восстановительных реакций.
Контрольные вопросы
1. Какие реакции называются окислительно-восстановительными? Приведите примеры.
2. Какие процессы называются окислением, восстановлением? Как при этом изменяется степень окисления атомов элементов?
3. Какие вещества называются окислителями, восстановителями? Что происходит с окислителем и восстановителем в окислительно-восстановительном процессе?
5. Назовите наиболее распространенные окислители, восстановители, вещества, обладающие двойственной окислительно-восстановительной функцией. Приведите примеры реакций с участием этих веществ.
6. Как изменяются окислительно-восстановительные свойства простых веществ в зависимости от положения соответствующих элементов в периодической системе Д.И. Менделеева?
7. Перечислите основные типы окислительно-восстановительных реакций.
8. Какие окислительно-восстановительные реакции называются а) межмолекулярными; б) внутримолекулярными; в) реакциями самоокисления-самовосста-новления (диспропорционирования)? Приведите примеры.
9. Какова роль среды в окислительно-восстановительных реакциях? На примерах восстановления перманганата калия покажите влияние среды на протекание окислительно-восстановительных реакций.
9. В чем состоит сущность а) электронного; б) ионно-электронного методов расстановки коэффициентов в окислительно-восстановительных реакциях?
Задачи
1. Определите тип следующих окислительно-восстановительных реакций:
а) 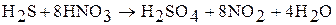 ;
;
б)  ;
;
в)  ;
;
г)  ;
;
д)  .
.
2. Какие из перечисленных веществ и за счет каких элементов проявляют обычно окислительные свойства и какие – восстановительные? Укажите вещества, которые обладают окислительно-восстановительной двойственностью:  ,
, 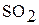 ,
,  ,
, 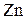 ,
,  ,
,  ,
,  ,
,  ,
,  .
.
3. Определите, к какому типу окислительно-восстановительных процессов относятся химические реакции, описываемые уравнениями:
а)  ;
;
б)  ;
;
в) 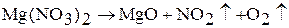 .
.
Подберите коэффициенты в уравнениях реакций методом электронного баланса.
4. Используя метод ионно-электронного баланса, подберите коэффициенты в следующих окислительно-восстановительных реакциях:
а) 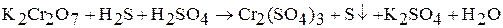 ;
;
б) 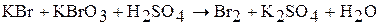 ;
;
в)  .
.
5. Закончите уравнения реакций и подберите коэффициенты методом ионно-электронного баланса:
а)  ;
;
б)  ;
;
в)  ;
;
г) 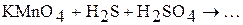 .
.
РАБОТА №16. ПОЛУЧЕНИЕ И СВОЙСТВА
КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Цель работы: изучить свойства и способы получения комплексных соединений.
Химическая посуда: штатив с пробирками, держатель для пробирок.
Реактивы: цинк (гранулированный), роданид калия, гексацианоферрат (III) калия.
Растворы: соляная кислота (2 н.), серная кислота (2 н.), гидроксид натрия (2 н.), аммиак водный (25%-ный), нитрат серебра (0,1 н.), хлорид натрия (насыщ.), йодид калия (0,1 н.), бромид калия (0,1 н.), сульфат меди (II) (0,5 н.), сульфат никеля (II) (0,5 н.), нитрат ртути (II) (0,5 н.), хлорид железа (III), гексацианоферрат (III) калия (0,5 н.), гексацианоферрат (II) калия (0,5 н.), тиосульфат натрия (1 н.), роданид аммония, перманганат калия, бензол.
Дата добавления: 2015-07-25; просмотров: 200 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №4. Окислительно-восстановительная двойственность пероксида водорода | | | Опыт №1. Получение комплексных соединений меди, серебра и ртути |