
Читайте также:
|
1. К 1 – 2 мл раствора хлорида алюминия прибавьте такой же объем раствора карбоната натрия. Что наблюдаете? Напишите ионно-молекулярное и молекулярное уравнения реакций.
2. Отфильтруйте образовавшийся осадок и промойте его на фильтре горячей водой для удаления избытка карбоната натрия. Опытным путем докажите, что образовавшийся осадок является гидроксидом алюминия. Напишите соответствующие уравнения химических реакций в молекулярном и ионном виде.
Контрольные вопросы
1. Какие реакции называются реакциями гидролиза солей? Какие соли подвергаются гидролизу и почему?
2. Почему соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу?
3. В каких случаях при гидролизе образуются: а) кислые соли, б) основные соли? Приведите по одному примеру. Напишите ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
4. Какими количественными величинами характеризуется гидролиз? Какая связь между этими величинами?
5. Какие факторы влияют на степень гидролиза солей? Перечислите факторы, приводящие а) к увеличению степени гидролиза; б) к уменьшению степени гидролиза.
6. Как изменяется степень гидролиза солей при а) повышении температуры; б) разбавлении раствора? Почему?
7. В каких случаях процесс гидролиза обратим, а когда идет до конца? Почему невозможно получить сульфид алюминия в водной среде?
Задачи
1. Какие из перечисленных солей подвергаются гидролизу: а) нитрат кальция; б) хлорид олова (II); в) арсенат натрия; г) сульфат меди (II)? Для этих солей составьте ионно-молекулярные и молекулярные уравнения гидролиза. В тех случаях, когда гидролиз протекает ступенчато, напишите уравнения гидролиза для каждой ступени. Укажите характер среды и рН.
2. Выведите выражение константы гидролиза соли 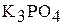 для каждой ступени. Рассчитайте константу гидролиза соли для всех ступеней. Сделайте вывод о возможности протекания гидролиза соли
для каждой ступени. Рассчитайте константу гидролиза соли для всех ступеней. Сделайте вывод о возможности протекания гидролиза соли 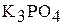 по второй и третьей ступеням при обычных условиях. Объясните, как повлияет на гидролиз соли
по второй и третьей ступеням при обычных условиях. Объясните, как повлияет на гидролиз соли 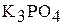 разбавление раствора и нагревание.
разбавление раствора и нагревание.
3. К раствору хлорида железа (III) добавили а) 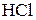 ; б)
; б) 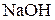 ; в)
; в) 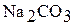 ; г)
; г) 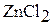 ; д)
; д) 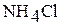 ; е)
; е) 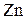 ; ж)
; ж) 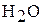 . В каких случаях гидролиз соли хлорида железа (III) усилится? Почему? Напишите ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
. В каких случаях гидролиз соли хлорида железа (III) усилится? Почему? Напишите ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
4. Водородный показатель 0,003 н. раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза соли.
5. Вычислите степень гидролиза и рН раствора а) 0,2 М 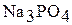 ; б) 0,8 М
; б) 0,8 М 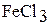 , считая, что гидролиз идет только по первой ступени.
, считая, что гидролиз идет только по первой ступени.
6. При сливании растворов хлорида хрома (III) и карбоната натрия образуется осадок гидроксида хрома (III). Объясните причину данного явления и напишите соответствующие молекулярное и ионно-молекулярное уравнения химических реакций.
РАБОТА №15. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы: ознакомиться с наиболее распространенными окислителями и восстановителями, а также с различными типами окислительно-восстановительных реакций.
Химическая посуда: штатив с пробирками, стеклянная палочка, пипетки, шпатели.
Реактивы: оксид марганца (IV), сульфат железа (II), сульфат марганца (II), сульфит натрия.
Растворы: гидроксид натрия (2 М), гидроксид калия (конц.), серная кислота (2 н.), дихромат калия (0,5 н.), хлорид олова, хлорид железа (0,5 н.), роданид аммония (0,5 н.), нитрат висмута, йодид калия (0,5 н.), пероксид водорода (3%), перманганат калия.
Дата добавления: 2015-07-25; просмотров: 171 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №5. Влияние температуры на степень гидролиза | | | Опыт №3. Окислительные свойства ионов металлов |