
|
Читайте также: |
Соли, образованные слабым основанием и слабой кислотой, гидролизуются и по катиону и по аниону:
CH3COONH4 + H2O «CH3COOH + NH4OH
или в ионной форме:
CH3COO- + NH4+ + H2O «CH3COOH + NH4OH
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота.
Реакция водного раствора этой соли будет слабощелочной, почти нейтральной (pH = 7–8).
J Упражнения:
Напишите уравнения реакций в молекулярной и ионной формах:
1. Соляная кислота + нитрат серебра, хлорид бария + серная кислота, гидроксид натрия + хлорид аммония, карбонат натрия + гидроксид кальция, гидроксид железа + азотная кислота.
2. Определите массовую долю (в%) хлорида натрия в растворе, полученном при растворении хлорида натрия массой 20 г в воде объемом 300мл
3. Определите молярную концентрацию раствора фосфорной кислоты, в 500 мл которого содержится фосфорной кислоты массой 9,8 г.
4. Сколько граммов гидроксида натрия содержится в растворе массой 250 г с массовой долей гидроксида натрия 20%
5. Напишите уравнение гидролиза следующих солей: хлорид алюминия, нитрат калия, нитрит калия, сульфат меди, хлорид бария, фосфат натрия, бромид цинка.
1.10ВОДОРОД
Водород H - первый элемент в периодической системе, самый распространённый элемент во Вселенной (92%); в земной коре массовая доля водорода составляет всего 1%.
Впервые выделен в чистом виде Г. Кавендишем в 1766 г. В 1787г. А.Лавуазье доказал, что водород - химический элемент.
Атом водорода состоит из ядра и одного электрона. Электронная конфигурация - 1S1. Молекула водорода двухатомная. Связь ковалентная неполярная.
Изотопы:
| Н - протий (99,98% по массе); | |
| D - дейтерий (0,02%); | |
| T - тритий (получен искусственно). | |
Физические свойства.
Водород - газ, бесцветный, без запаха; t°кип = -253°C; t°пл = -259°C; почти не растворяется в воде (в 100V H2O растворяется 2V H2); легче воздуха. D (по воздуху) = 0,069.
Способы собирания.
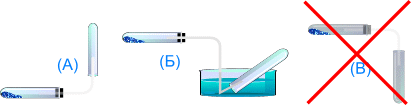
| ||
| Вытеснением воды | Вытеснением воздуха |
Получение
1) взаимодействие активных металлов с кислотами - неокислителями:
Zn + 2HCl ® ZnCl2 + H2
2) взаимодействие алюминия (или цинка) с водными растворами щелочей:
2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
3) электролиз воды и водных растворов щелочей и солей:
2H2O ® 2H2 + O2
2NaCl + 2H2O ® H2 + Cl2 + 2NaOH
4) пропускание паров воды над раскалённым углём при 1000°C:
C + H2O «CO + H2
5) конверсия метана при 900°C:
CH4 + H2O «CO + 3H2
Методы (1,2) используют в лаборатории, (3-5) используют в промышленности.
Дата добавления: 2015-07-25; просмотров: 157 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Величина pH используется для характеристики раствора. | | | ОБЩАЯ ХАРАКТЕРИСТИКА |