
Читайте также:
|
А) 1. В два химических стакана на 50 мл налейте примерно по 20 мл (около 1/3 объема) 1 М растворов сульфита натрия и карбоната натрия.
2. Измерьте рН растворов с помощью рН-метра.
3. Напишите ионно-молекулярные и молекулярные уравнения гидролиза солей по первой ступени.
4. По величине рН вычислите и определите, в каком из двух растворов больше: а) концентрация гидроксогрупп [ОН–]; б) константа гидролиза 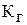 по первой ступени; в) степень гидролиза h. Результаты вычислений занесите в табл. 17.
по первой ступени; в) степень гидролиза h. Результаты вычислений занесите в табл. 17.
Таблица 17
| Формула соли | рН | [ОН–] | 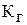
| h |
| ||||
|
5. Сделайте вывод о влиянии природы кислот, образующих соль, на степень ее гидролиза.
Б) 1. В два химических стакана на 50 мл налейте примерно по 20 мл (около 1/3 объема) 1 М растворов хлорида магния и хлорида алюминия. Измерьте рН растворов с помощью рН-метра.
2. Напишите ионно-молекулярные и молекулярные уравнения гидролиза по первой ступени.
3. По величине рН вычислите и определите, в каком из двух растворов больше: а) концентрация ионов водорода [Н+]; б) константа гидролиза 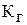 по первой ступени; в) степень гидролиза h. Результаты вычислений занесите в табл. 18.
по первой ступени; в) степень гидролиза h. Результаты вычислений занесите в табл. 18.
Таблица 18
| Формула соли | рН | [Н+] | Kг | h |
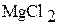
| ||||
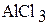
|
4. Сделайте вывод о влиянии природы оснований, образующих соль, на степень ее гидролиза.
Дата добавления: 2015-07-25; просмотров: 50 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №1. Определение реакции среды растворов солей при гидролизе | | | Опыт №4. Влияние разбавления раствора на степень гидролиза |