
Читайте также:
|
Влияние изменения концентрации веществ на смещение химического равновесия рассмотрим на примере химической реакции между хлоридом железа (III) 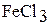 и роданидом аммония
и роданидом аммония 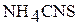 :
:
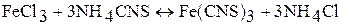 .
.
Роданид железа (III)  , образующийся в результате данной реакции, придает раствору ярко красную окраску. Раствор хлорида железа (III)
, образующийся в результате данной реакции, придает раствору ярко красную окраску. Раствор хлорида железа (III) 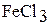 имеет слабо желтую окраску, а растворы роданида аммония
имеет слабо желтую окраску, а растворы роданида аммония 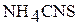 и хлорида аммония
и хлорида аммония 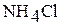 – бесцветны. Поэтому изменение интенсивности окраски раствора позволяет судить об изменении концентрации роданида железа (III)
– бесцветны. Поэтому изменение интенсивности окраски раствора позволяет судить об изменении концентрации роданида железа (III)  , то есть о смещении химического равновесия в исследуемой реакционной системе.
, то есть о смещении химического равновесия в исследуемой реакционной системе.
1. В химический стакан на 50 мл налейте примерно 20 мл (около 1/3 объема) дистиллированной воды и добавьте по 2 – 3 капли насыщенных растворов хлорида железа (III) 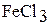 и роданида аммония
и роданида аммония 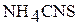 . Отметьте окраску раствора.
. Отметьте окраску раствора.
2. Полученный раствор разделите примерно поровну на четыре пробирки, одна из которых будет являться контрольной.
3. В остальные три пробирки добавьте следующие реактивы: в первую – 2 –3 капли раствора хлорида железа (III) 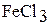 ; во вторую – такое же количество раствора роданида аммония
; во вторую – такое же количество раствора роданида аммония 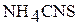 ; в третью – кристаллический хлорид аммония
; в третью – кристаллический хлорид аммония 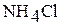 .
.
4. Перемешайте растворы с помощью стеклянной палочки. Сравните интенсивность окраски полученных растворов с интенсивностью окраски раствора в контрольной пробирке. Результаты опыта занесите в табл. 10.
5. На основании принципа Ле Шателье-Брауна объясните изменение интенсивности окраски растворов.
6. Напишите выражение для константы химического равновесия исследуемой обратимой реакции. Объясните наблюдаемые явления, используя выражение константы химического равновесия.
7. Сделайте вывод о влиянии изменения концентрации веществ на смещение химического равновесия.
Таблица 10
Дата добавления: 2015-07-25; просмотров: 94 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Опыт №4. Ингибирование. Взаимодействие железа с соляной кислотой | | | Опыт №3. Влияние среды раствора на смещение химического равновесия |